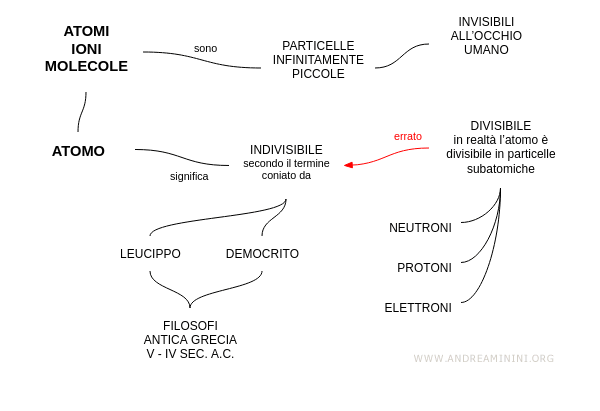
L'atomo
L'atomo è l'unità elementare che conserva inalterate le proprietà chimiche e fisiche della materia. E' composto da particelle subatomiche dette protoni, neutroni ed elettroni. I protoni e i neutroni formano il nucleo dell'atomo mentre gli elettroni vi orbitano intorno.
La prima idea dell'atomo di Democrito
L'esistenza dell'atomo venne ipotizzata per la prima volta dai filosofi greci Leucippo e Democrito nel IV-V secolo avanti Cristo. Secondo Democrito, la materia è composta da unità elementari e indivisibili dette atomi.
Cosa significa atomo
Il termine greco ἄτομος ( atomo ) significa indivisibile.
In realtà l'atomo non è indivisibile perché è composto da particelle elementari subatomiche ( neutroni, protoni, elettroni a loro volta composti da quark ). L'atomo è soltanto l'unità della materia che mantiene inalterate le proprietà chimico-fisiche. E' importante soprattutto l'idea di Democrito di un'unità elementare, indivisibile e indistruttibile, di cui è composta tutta la materia.
Democrito ipotizzò l'esistenza dell'atomo tramite il ragionamento e le speculazioni filosofiche. Non c'era nulla di scientifico. Il filosofo greco aveva immaginato una verità scientifica senza vederla e senza avere una prova.
Il concetto di atomo introdotto da Democrito cadde nell'oblio per molti secoli. Venne riscoperto nel XVIII e XIX secolo quando l'uomo cominciò a svolgere delle osservazioni scientifiche sulle reazioni chimiche.
La teoria atomica di Dalton
Il primo ad accorgersi della presenza dell'atomo fu John Dalton. Durante i suoi esperimenti, lo scienziato inglese notò che gli elementi chimici tendono a combinarsi tra loro secondo proporzioni prestabilite della massa espresse da numeri interi, detta legge delle proporzioni multiple.
Esempio di proporzioni multiple atomiche. Il carbonio ( C ) e l'ossigeno ( O ) sono due elementi chimici diversi e si combinano tra loro per formare l'ossido di carbonio ( CO ). Dalton si accorse che il rapporto della massa tra carbonio e ossigeno è sempre uguale a 12/16. Aggiungendo un atomo di ossigeno si ottiene il biossido di carbonio ( CO2 ) e il rapporto tra la massa raddoppia 12/32.
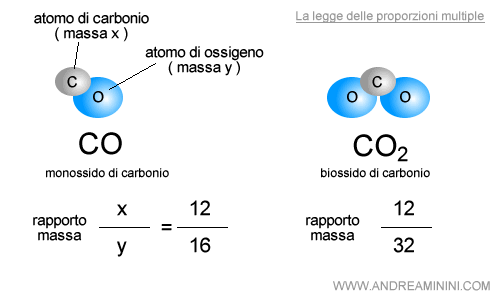
I rapporti di massa erano espressi sempre con numeri interi. Secondo Dalton questo fenomeno aveva un'unica spiegazione possibile, la materia era composta da unità elementari indivisibili, ossia dagli atomi degli elementi chimici.
Ogni elemento chimico ha un atomo con proprietà specifiche. Inoltre, tutti gli atomi dello stesso elemento chimico ( es. ossigeno ) sono identici tra loro. Fu un grande passo in avanti rispetto all'atomo immaginato dal filosofo greco Democrito duemila anni prima.
La teoria atomica di Dalton si basava su una semplice deduzione, lo scienziato non aveva ancora osservato direttamente gli atomi. Tuttavia , fu la prima ipotesi a essere costruita usando il metodo scientifico sperimentale.
L'atomo di Thomson
Quale modello propose Thomson per l'atomo
Nel 1897 lo scienziato inglese Joseph John Thomson scoprì l'esistenza di particelle subatomiche con carica negativa dentro l'atomo. Si trattava degli elettroni.
Da questa osservazione Thomson dedusse indirettamente l'esistenza di altre particelle con carica positiva ( protoni ).
Come dedusse l'esistenza dei protoni? Il ragionamento logico dello scienziato è molto semplice. Poiché la materia è neutra, se esiste una particella negativa ( elettrone ), allora deve esistere dentro l'atomo anche un'altra particella con carica opposta, ossia positiva ( protone ), in grado di compensarla esattamente.
Nel 1904 Thomson costruì il primo modello atomico moderno. Immaginò l'atomo come una sfera composta da elettroni e protoni, distribuiti in modo uniforme nel nucleo dell'atomo
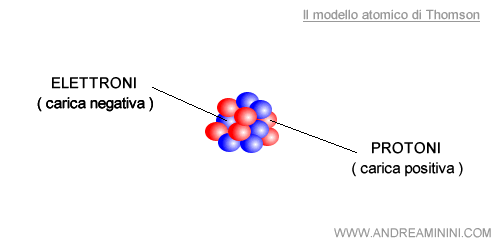
Nota. In realtà l'elettrone è una particella subatomica con carica elettrica negativa che orbita intorno al nucleo dell'atomo. Non si trova dentro il nucleo dell'atomo. Pertanto, il modello atomico di Thomson è errato. Tuttavia, fu un ulteriore passo in avanti verso la verità scientifica.
Con la scoperta degli elettroni il concetto di atomo smise di essere visto come l'unità indivisibile della materia.
Il modello atomico di Rutherford
Ernest Rutherford era uno degli studenti di Thomson e continuò i suoi studi sull'atomo. Rutherford scoprì l'esistenza del nucleo atomico.
Quale fenomeno indusse Rutherford a proporre un modello di atomo nucleare
Nel 1911 Rutherford si accorse che gli elettroni non potevano risiedere in una sfera centrale insieme ai protoni, come pensava Thomson, ma orbitavano nello spazio esterno intorno al nucleo dell'atomo.
Come fece a capire la natura degli elettroni? Rutherford bombardò una lamina sottile d'oro con un fascio di particelle con carica elettrica positiva ( radiazione alfa ). A contatto con il metallo le particelle subirono deviazioni di 90° nella traiettoria. Questo non sarebbe dovuto accadere se la materia fosse composta in modo uniforme da elettroni e protoni. Si poteva spiegare con l'elettromagnetismo soltanto con la presenza delle particelle con carica positiva ( protoni ) concentrate nel nucleo e uno spazio vuoto intorno. A contatto con i protoni, avendo la stessa carica elettrica positiva, le particelle alfa erano respinte dall'elettromagnetismo e deviate in tutte le angolazioni.
Nel modello atomico di Rutherford la struttura dell'atomo è composta da un nucleo centrale in cui sono concentrate le particelle con carica positiva ( protoni ).
Le particelle con carica negativa ( elettroni ) si trovano, invece, in un'orbita esterna al nucleo.
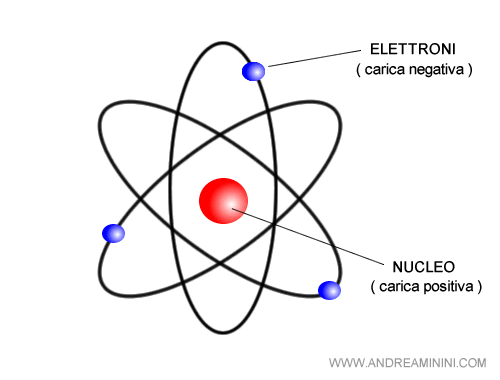
Pertanto, secondo Rutherford il nucleo atomico ha una dimensione notevolmente inferiore rispetto al volume dello spazio occupato dall'atomo nella materia.
Nota. L'atomo di Rufherford somiglia molto al sistema solare, dove i pianeti ( elettroni ) orbitano intorno al Sole ( nucleo ) seguendo orbite ellittiche. La rappresentazione grafica di Rutherford è stata adottata come il simbolo dell'atomo.
Le incongruenze del modello di Rutherford
Il modello di Rutherford era sicuramente più avanzato dei precedenti ma lasciava aperte molte domande e incongruenze teoriche irrisolte.
- La forza di attrazione elettrostatica tra elettroni e protoni dovrebbe far cadere gli elettroni sul nucleo, anziché orbitare intorno. Si tratta di cariche opposte, quindi si attraggono.
- Gli elettroni sono particelle accelerate con carica negativa ed emettono onde elettromagnetiche quando orbitano intorno all'atomo. Secondo le leggi classiche dell'elettromagnetismo, se emette onde elettromagnetiche allora l'elettrone dovrebbe perdere progressivamente energia. Pertanto, a causa della forza centripeta dovrebbe spostarsi in orbite sempre più vicine al nucleo, fino a cadervi sopra.
Il modello di atomo di Bohr
Nel 1913 il fisico danese Niels Bohr propose un nuovo modello atomico per evitare le incongruenze del modello di Rutherford. Per costruirlo utilizzò le basi della teoria quantistica, scoperta pochi anni prima da Max Planck.
Nel modello atomico di Bohr gli elettroni percorrono delle orbite stazionarie circolari intorno al nucleo. Tuttavia, non tutte le orbite ma soltanto quelle a determinate distanze dal nucleo.
L'orbita stazionaria più vicina al nucleo, quella più interna, si trova a una distanza costante pari a 5,2917·10-11 metri detta raggio di Bohr.
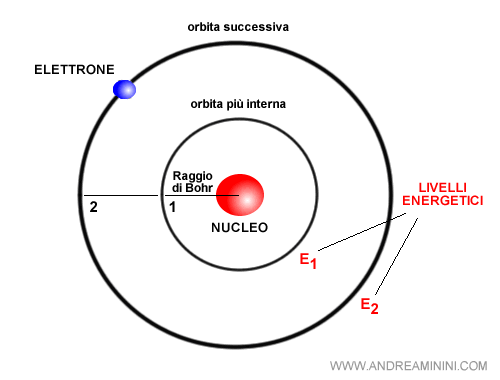
Nel modello c'è una particolarità molto importante, tutte le orbite più esterne sono multipli interi del raggio di Bohr.
Nota. Il valore multiplo intero che lega le orbite degli elettroni fornisce una spiegazione anche a un'evidenza empirica notata dal fisico svizzero Johann Jakob Balmer sullo spettro atomico dell'atomo di idrogeno, conosciuta come serie di Balmer.
In pratica, gli elettroni possono trovarsi soltanto in orbite stazionarie a specifiche distanze dal nucleo. Non possono trovarsi a qualsiasi distanza dal nucleo.
Inoltre, a ogni orbita è associato un livello energetico diverso. L'energia è più alta nelle orbite esterne ( En ) e più bassa in quelle interne ( En-1 , En-2 , E1 ).
Secondo Bohr, quando un elettrone salta da un'orbita esterna a una più interna, emette una quantità di energia ( En - En-1 ) pari a quella di un fotone. Viceversa, quando l'elettrone assorbe una quantità di energia sufficiente, si sposta da un'orbita più interna a una più esterna.
Quando si trova in un'orbita stazionaria l'elettrone non irradia energia. Per questa ragione l'elettrone non cade sul nucleo. In questo modo Bohr risponde a uno dei principali dubbi sollevati sull'atomo di Rutherford.
L'equazione di Schrodinger
Il modello atomico di Bohr lasciava però ancora molte questioni irrisolte.
Le orbite degli elettroni non potevano essere calcolate con precisione a causa del principio di indeterminazione di Heisenberg che impedisce di rilevare contemporaneamente la posizione e la velocità di una particella.
Nota. L'osservazione modifica il moto, la posizione e la velocità degli elettroni, in quanto i fotoni della luce interagiscono con le particelle subatomiche e ne modificano il moto. Pertanto, non è possibile misurare con certezza la posizione e la velocità degli elettroni nello spazio.
Inoltre, quando l'atomo ha molti elettroni, tra questi si crea una forza di repulsione coulombiana tra cariche negative. Pertanto, le orbite non potevano essere circolari.
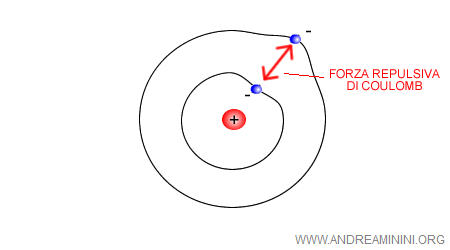
Nel 1926 il fisico austriaco Erwin Schrödinger elaborò un'equazione ( detta equazione di Schrödinger ) per calcolare l'orbita più probabile degli elettroni, ossia l'onda di probabilità degli elettroni.
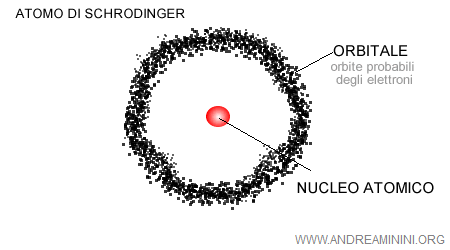
La rappresentazione dell'atomo come modello planetario cadde in disuso. Al suo posto venne proposta l'idea di una regione dello spazio atomico detto orbitale atomico, in cui si trovano con maggiore probabilità le orbite degli elettroni.
Nota. Con l'equazione di Schrödinger si affermò anche il paradigma scientifico di incertezza.
L'atomo quantistico
L'atomo quantistico è l'attuale modello atomico nella fisica moderna. E' il risultato della ricerca scientifica nella meccanica delle particelle, unisce gli sforzi di Rutherford, Bohr, Schrodinger, Heisenberg, Einstein e molti altri.
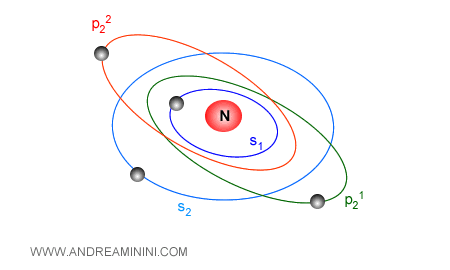
Gli elettroni orbitano negli orbitali dei livelli energetici e sono caratterizzati da quattro parametri detti numeri quantici:
- Il numero quantico principale. E' il livello energetico in cui si trova l'orbitale e misura il livello di energia.
- Il numero quantico azimutale ( secondario o angolare ). E' la forma dell'orbitale.
- Il numero quantico magnetico. E' l'orientazione dell'orbitale nello spazio.
- Il numero quantico di spin elettrico. E' il momento angolare ossia la sua rotazione della particella ( elettrone ) intorno al proprio asse.
Mappa concettuale dell'atomo
Altri approfondimenti sull'atomo
- Lo spettro atomico
- Il modello atomico di Bohr
- La struttura e la composizione
- Il nucleo dell'atomo
- I neutroni, protoni ed elettroni
- I quark
- La carica elettrica
- L'atomo quantistico
- L'assorbimento e l'emissione del fotone
- Lo ione positivo o negativo ( atomo con stato ionizzato )
- Gli isotopi
- L'equazione di Schrodinger
- Gli orbitali
- Il principio di Pauli (regola del doppietto elettronico)
- La regola di Hund (principio della molteplicità)
- Le regole di riempimento degli orbitali
- I numeri quantici
- Le particelle subatomiche ed elementari
- La configurazione elettronica
- Le dimensioni atomiche (volume atomico)
- Il raggio atomico
- L'energia di ionizzazione
- L'affinità elettronica
- L'elettronegatività
- L'energia di legame
- La regola dell'ottetto
- Le strutture di Lewis
- FAQ ( atomo )
