La struttura e la composizione dell'atomo
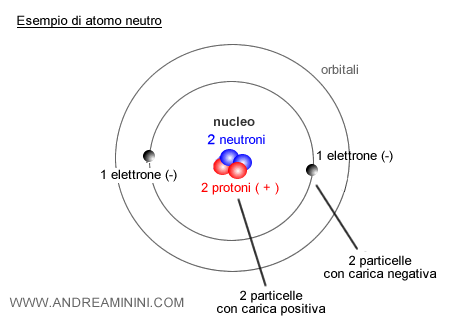
Un atomo è formato da due parti fondamentali: un nucleo centrale, con carica elettrica positiva, e delle particelle in orbita attorno a esso, con carica negativa.
Il nucleo, a sua volta, contiene due tipi di particelle: i protoni, che hanno carica positiva, e i neutroni, che non hanno carica, sono neutri.
Attorno al nucleo orbitano gli elettroni, piccolissime particelle cariche negativamente.
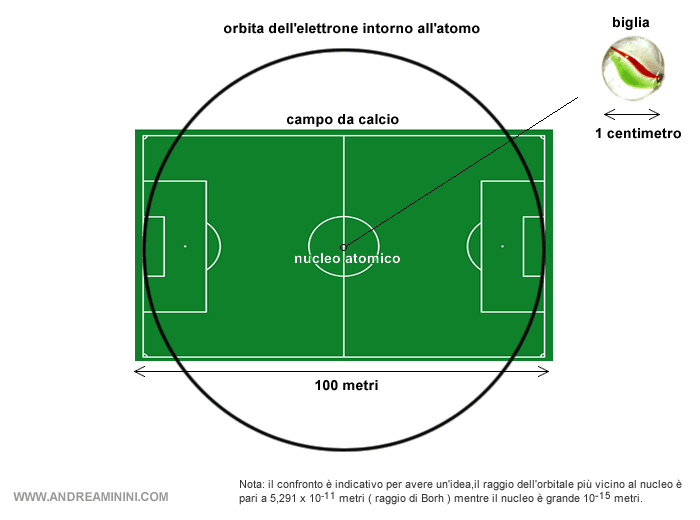
Ora, proviamo a immaginare le proporzioni: Il nucleo è piccolissimo rispetto all’intero atomo e occupa soltanto una minima parte della dimensione dell'atomo se si considerano anche le orbite degli elettroni.
Questo significa che l’atomo è composto per la maggior parte… da spazio vuoto.
Nota. Considerando anche le orbite degli elettroni, un atomo è grande 10-10 metri. Il nucleo atomico, invece, è grande soltanto 10-15 metri. In altri termini, il nucleo atomico è diecimila volte più piccolo dell'atomo. All'incirca è come mettere una biglia al centro di un campo da calcio. La biglia rappresenta il nucleo atomico, mentre il campo intero, con tutto lo spazio vuoto, rappresenta l’atomo ossia lo spazio dove orbitano gli elettroni.
Quanti protoni, neutroni ed elettroni ci sono in un atomo?
In un atomo neutro il numero dei protoni è uguale al numero degli elettroni.
Quando il numero dei protoni eguaglia quello degli elettroni, la carica elettrica positiva dei protoni compensa esattamente la carica elettrica negativa degli elettroni.
Il numero dei protoni è anche detto numero atomico ed è indicato con la lettera Z. E' fondamentale perché individua l'elemento chimico.
Esempio. Un atomo di idrogeno è l’elemento più leggero e abbondante nell’universo, presente nell’acqua e nelle stelle. Ha sempre un solo protone, quindi il suo numero atomico è Z=1. Il carbonio ha sempre 6 protoni, quindi il suo numero atomico è Z=6. L'ossigeno ha sempre otto protoni nel nucleo, quindi il suo numero atomico è Z=8, ecc.

Il numero atomico (Z) dell'atomo non va confuso con il numero di massa (A) che, invece, è determinato dalla somma dei protoni Z ( numero atomico ) e dei neutroni ( N ) presenti nell'atomo.
A = Z + N
Esempio. Il carbonio ha sempre Z = 6 protoni, ma può avere 6 neutroni (A = 12, carbonio-12) oppure 7 neutroni (A = 13, carbonio-13). In entrambi i casi resta un atomo di carbonio.
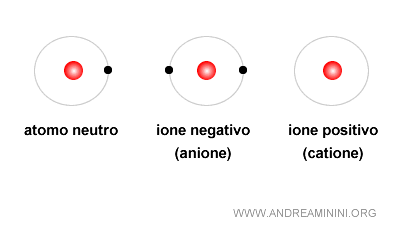
Il caso dello ione
Quando i protoni e gli elettroni sono in numero uguale, le cariche si compensano, e l’atomo è neutro. Se invece questo equilibrio si rompe, l’atomo diventa uno ione.
- Ione positivo (o catione) se il numero di protoni è superiore a quello degli elettroni
- Ione negativo (o anione) se il numero degli elettroni è superiore a quello dei protoni.
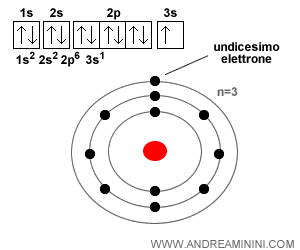
Esempio. Un atomo di sodio ( $Na $) ha 11 elettroni quando è in forma neutra, perché il suo numero atomico Z è 11 (cioè ha 11 protoni, e quindi anche 11 elettroni). La sua configurazione elettronica è: $$ 1s^2 \; 2s^2 \; 2p^6 \; 3s^1 $$ Quindi ha 2 elettroni nel primo livello, 8 nel secondo e 1 solo elettrone nel terzo livello (quello più esterno). Proprio questo unico elettrone esterno è molto facile da perdere ed è il motivo per cui il sodio forma facilmente lo ione positivo $ Na^+ $. E' uno dei motivi per cui si lega con con uno ione negativo di Cloro ( $ Cl^- ) $ formano una molecola di cloruro di sodio $ Na^+Cl^- $, cioè… il comune sale da cucina
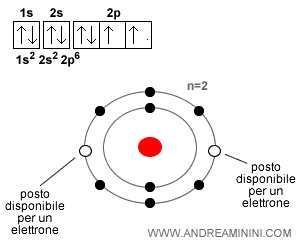
Facciamo un altro esempio. L'ossigeno ( $ O $ ) con Z = 8, in forma neutra ha 8 protoni e 8 elettroni, ma tende a catturare altri due elettroni per completare l'ottetto e diventare stabile, formando lo ione ossido ( $ O^{-2} $ ). Nel livello energetico ( $n=2$ ci sono due posti disponibilil su otto posti complessivi. Il completamento di tutti i posti ("ottetto") fornisce all'atomo una maggiore stabilità. Per questa ragione l'ossigeno tende a catturare due elettroni diventando uno ione negativo.
E il numero dei neutroni?
Per capire quanti neutroni (N) ha un atomo, è utile conoscere il numero atomico (Z) e il numero di massa (A) dell'atomo.
N = A - Z
Pertanto, il numero dei neutroni è pari alla differenza tra il numero di massa e il numero atomico.
Il numero dei neutroni non determina l’identità dell’elemento chimico: questa dipende solo dal numero di protoni, cioè dal numero atomico Z.
I neutroni, invece, influiscono sulla massa dell’atomo e sono alla base del fenomeno degli isotopi.
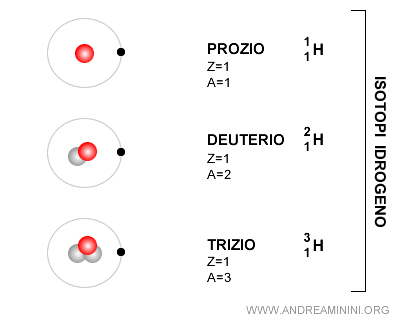
Cos'è un isotopo? Gli isotopi sono atomi dello stesso elemento chimico, quindi con lo stesso numero atomico Z (numero di protoni) ma con un numero diverso di neutroni (N), quindi con una massa diversa. In altre parole, gli isotopi sono tipi di atomi appartenenti allo stesso elemento chimico, hanno lo stesso numero atomico ma una massa atomica differente. Si chiama "isotopo" perché occupa lo stesso posto dell'elemento chimico nella tavola periodica. Un esempio? L’idrogeno H esiste nella forma più comune con un protone e un elettrone, senza neutroni. Ma l'idrogeno esiste come deuterio, con un protone, un elettrone e un neutrone. Esiste anche come trizio, con un protone, un elettrone e due neutroni. Sono tutti isotopi dell'idrogeno.
Poiché i neutroni non hanno carica elettrica, non modificano lo stato elettrico dell’atomo.
Tuttavia, il loro numero è fondamentale per un altro motivo: la stabilità del nucleo.
Un atomo è detto stabile quando il suo nucleo non tende a trasformarsi spontaneamente.
Ma non tutti i nuclei sono così: alcuni sono instabili, e nel tempo decadono emettendo radiazioni per trasformarsi in nuclei più stabili.
È proprio grazie a questa instabilità che conosciamo fenomeni come la radioattività.
Esempio. Il carbonio-12 è stabile e costituisce la base della vita. E' composto da 6 neutroni e 6 protoni.
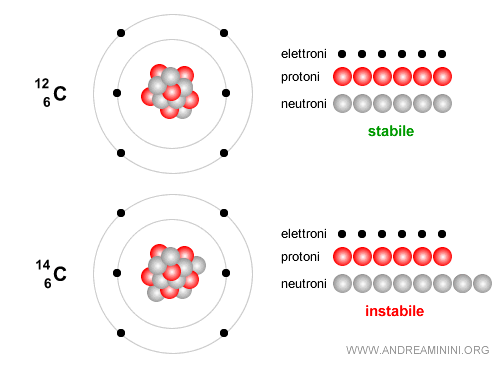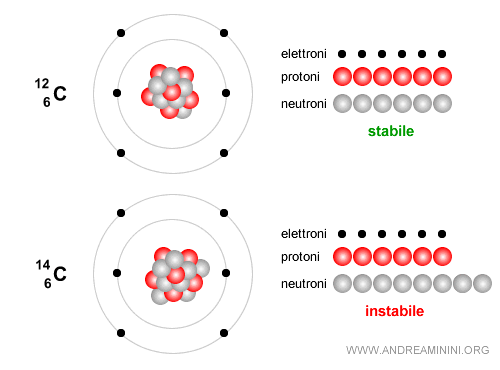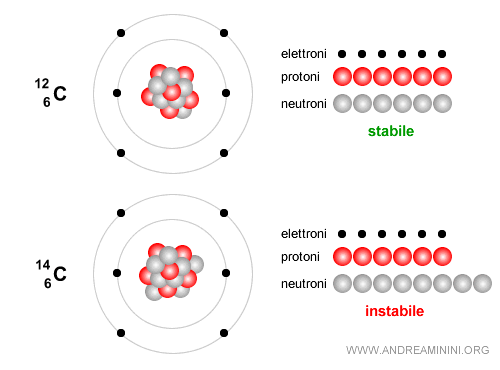
Al contrario, il carbonio-14 è composto da 6 protoni e 8 neutroni, quindi ha un numero di massa A=14 ed è un isotopo instabile che decade lentamente. Viene usato per datare i reperti archeologici e di reperti organici fino a circa 50.000 anni. Nel tempo decade attraverso un decadimento beta ( $ β^-$ ): $$ {}^{14}_6 C \;\;\longrightarrow\;\; {}^{14}_7 N \;+\; e^- \;+\; \bar{\nu}_e $$ In altre parole, uno dei neutroni del carbonio si trasforma in un protone, viene emesso un elettrone (detto particella beta meno) e un antineutrino elettronico e il nucleo diventa azoto-14 ( $ N $ ), che è stabile.

La disposizione degli elettroni
Gli elettroni non girano a caso intorno al nucleo: si dispongono in orbite quantizzate, chiamate orbitali. Ogni orbitale è una “regione di probabilità” in cui possiamo trovare l’elettrone.
Ogni singolo orbitale può ospitare al massimo due elettroni, uno con spin up e l'altro down, per rispettare il principio di esclusione di Pauli.
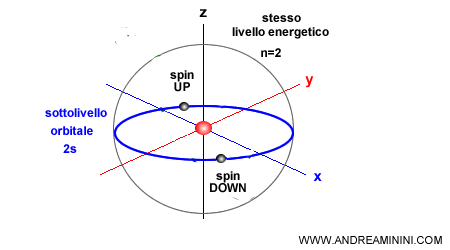
Gli orbitali si dividono in quattro tipi principali:
- s (sferici)
- p (a forma di doppio lobo),
- d (più complessi, con 4 o 5 lobi)
- f (ancora più articolati)
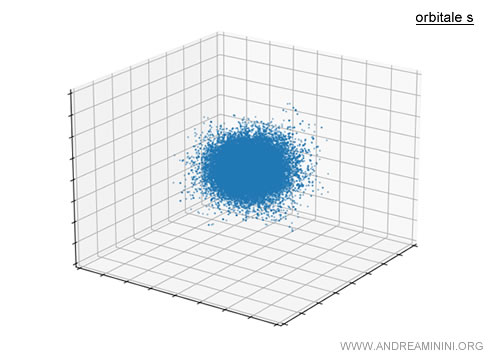
Ad esempio, l'orbitale s è uno spazio di forma sferica intorno al nucleo atomico.
Va detto che non è esattamente una sfera ma un insieme di punti in cui è probabile che gli elettroni possono trovarsi.
Gli orbitali di tipo $ p $ invece hanno una forma più allungata in tre direzioni diverse: $ p_x $, $ p_y $, $ p_z $.
Ogni orbitale di tipo $ p $ può ospitare al massimo due elettroni.
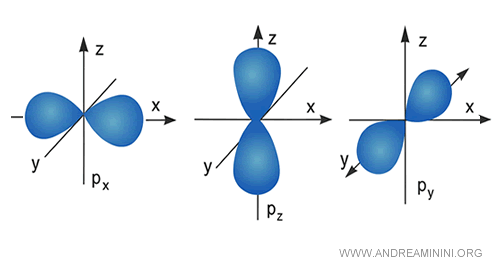
Il numero di orbitali disponibili aumenta con il livello energetico e anche le forme diventano via via più complesse.
Ad esempio, gli orbitali di tipo $ d $ hanno delle forme a quattro lobi, fatta eccezione per una di queste.
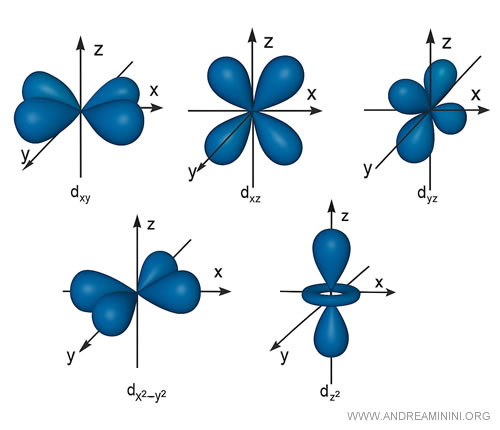
Anche in questo caso ogni orbitale può ospitare al massimo due elettroni e via dicendo.
Esempio. Il primo livello energetico $ n=1 $ contiene solo un orbitale $ s $. Quindi ha al massimo 2 elettroni. Il secondo livello energetico $ n=2 $ ha un orbitale $ s $ e tre orbitali $ p $. Quindi, ha quattro orbitali e può avere al massimo 8 elettroni. Quello che in chimica conosciamo come "ottetto".
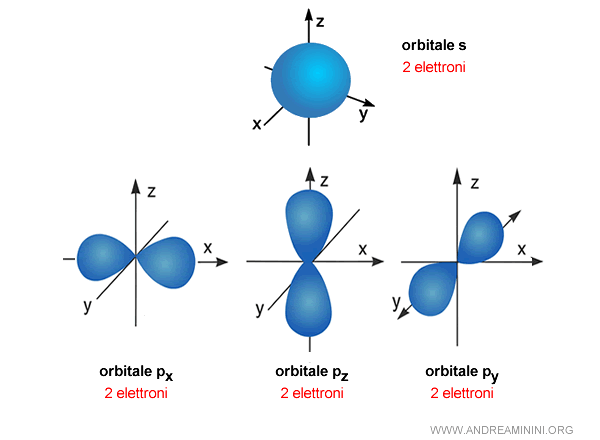
Il terzo livello energetico $ n=3 $ ha un orbitale $ s $, tre orbitali $ p $ e cinque orbitali $ d $. Quindi, ha 9 orbitali e può ospitare al massimo 18 elettroni e così via. Ecco i vari orbitali (s,p,d,f) nei primi n=7 livelli energetici.
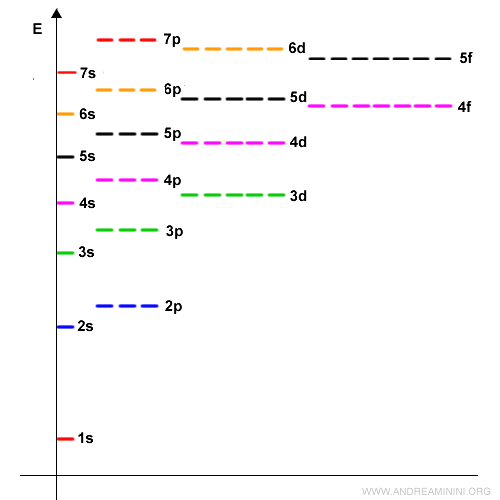
Come si può notare ci sono anche dei salti nei vari livelli energetici, perché gli elettroni occupano sempre gli orbitali con energia minore prima di passare a quelli più alti (regola "aufbau", dal tedesco "costruire"). Ad esempio, dopo aver riempito il $ 3p $, gli elettroni non vanno nel $ 3d $, ma nel $ 4s $, che è leggermente meno energetico, pur trovandosi nel livello energetico superiore $ n=4 $. Solo dopo occupano anche i posti disponibili nel $ 3d $. In breve: l’ordine non segue sempre i numeri dei livelli energetici $ n $, ma l’energia $ E $ crescente degli orbitali.
Questa disposizione degli elettroni è ciò che determina le proprietà chimiche di ogni elemento.
E così via.
