Strutture di Lewis
Cosa sono le strutture di Lewis
Le strutture di Lewis (o formule di Lewis) sono usate per rappresentare gli elettroni di valenza. Per ogni elettrone di valenza si aggiunge un punto intorno al simbolo dell'elemento chimico.
Le strutture di Lewis rappresentano anche il legame tra gli atomi in una molecola poliatomica.
Come scrivere le formule di Lewis
Il simbolo dell'elemento chimico (X) indica il nucleo atomico e la struttura interna degli elettroni non di valenza.
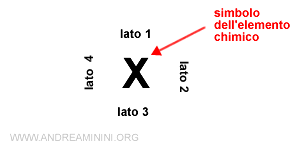
Ogni lato del simbolo dell'elemento chimico indica una coppia di elettroni di valenza negli orbitali superficiali di tipo ns np.
Nota. In ogni livello energetico (n) c'è un orbitale di tipo s e tre orbitali di tipo p. Pertanto i sono 4 orbitali in tutto. Secondo il principio di esclusione ogni orbitale atomico può ospitare al massimo due elettroni (doppietto). Quindi, gli elettroni di valenza sono al massimo 8.
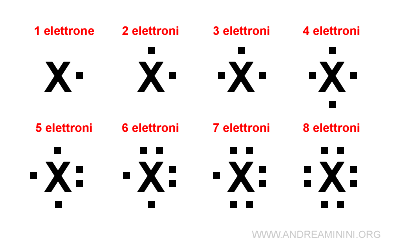
Come regola generale si colloca un punto su ciascun lato del simbolo chimico per i primi quattro elettroni di valenza.
Poi si aggiunge un secondo punto su ciascun lato per i successivi quattro elettroni.
La scelta dei lati dove inserire i puntini è soggettiva nelle strutture di Lewis.
Quindi, posso scrivere la stessa configurazione elettronica superficiale in modi diversi.

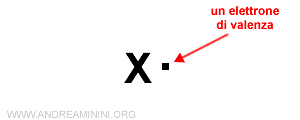
Ad esempio, per indicare un atomo con un solo elettrone di valenza, aggiungo un puntino su un lato.
Qualsiasi lato va bene. E' indifferente.
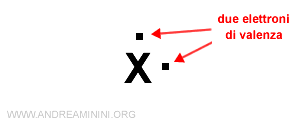
Per indicare un atomo con due elettroni di valenza aggiungo un puntino su due lati.
Quando ogni lato ha un punto, comincio ad aggiungere un doppio punto su ogni lato.
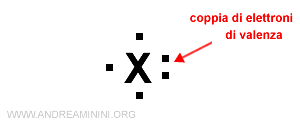
Nota. A volte al posto del doppio puntino si utilizza un segmento.
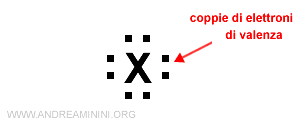
Poiché gli elettroni di valenza possono essere al massimo otto ( ottetto ), i quattro lati del simbolo chimico sono sufficienti a rappresentare la configurazione elettronica superficiale di qualsiasi elemento chimico.
Il caso dell'elio. L'elio è l'unico elemento chimico che fa eccezione alla regola generale della struttura di Lewis perché raggiunge la sua configurazione stabile 1s2 con due elettroni ( doppietto ). In questo caso la coppia di elettroni va scritta su un unico lato.

Per indicare un legame covalente tra due atomi scrivo i due elementi separati dalla coppia di elettroni di valenza in comune.

Per rappresentare uno ione positivo o negativo tolgo o aggiungo un punto alla struttura di Lewis e indico il segno della carica elettrica (positiva o negativa) in apice a destra del simbolo dell'elemento chimico.
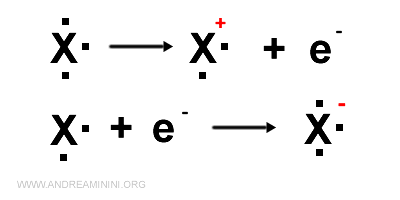
Quando l'atomo cede o acquista più di un elettrone, indico in apice anche il numero degli elettroni ceduti o acquisiti, seguiti dal segno della carica elettrica dello ione.
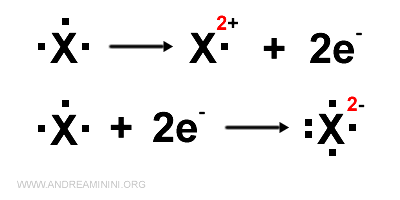
Un esempio pratico
Il berillio ha una configurazione superficiale 2s2. Quindi ha due elettroni.
La formula di Lewis del berillio è la seguente:
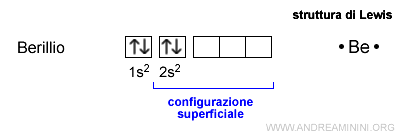
Nota. Nella configurazione elettronica superficiale si considerano soltanto gli orbitali del livello energetico più alto (numero quantico principale). Ad esempio, la configurazione elettronica del berillio è 1s2 2s2. Il livello energetico è n=2. Quindi, la configurazione superficiale del berillio è 2s2.
Altri esempi pratici di utilizzo delle formule di Lewis

Come formare i legami con le strutture di Lewis
Le strutture di Lewis sono utili anche per rappresentare il legame chimico tra gli atomi in una molecola.
Per scrivere i legami seguo questi passaggi:
- Calcolo la somma EV degli elettroni di valenza di tutti gli atomi della molecola.
- Calcolo la somma E* degli elettroni di valenza se tutti gli atomi avessero un ottetto o un duetto nel caso dell'idrogeno.
- Il numero delle coppie N di legame nella molecola è pari alla differenza E*-EV diviso due. $$ N = \frac{E*-EV}{2} $$
- Aggiungo un legame semplice tra gli atomi della molecola
- Eventuali coppie di legame rimanenti le aggiungo come legami doppi o tripli tra gli atomi, dove è necessario.
Dispongo i restanti elettroni delle coppie solitarie intorno agli atomi per soddisfare la regola dell'ottetto o del duetto.
Esempio
Prendo in considerazione la molecola d'acqua H2O. E' composta da un atomo di ossigeno e due atomi di idrogeno.
Ogni atomo di idrogeno ha un elettrone di valenza mentre l'ossigeno ha 6 elettroni di valenza. Quindi, la somma degli elettroni di valenza EV è
$$ EV = 1 + 1+ 6 = 8 $$
Gli atomi di idrogeno seguono la regola del duetto mentre l'atomo di ossigeno la regola dell'ottetto.
Quindi, la somma degli elettroni di valenza necessari è
$$ E* = 2 + 2 + 8 = 12 $$
Da questi dati deduco che la molecola ha due coppie di legame.
$$ N = \frac{E*-EV}{2} = \frac{12-8}{2} = \frac{4}{2} = 2 $$
A questo punto aggiungo i legami semplici tra gli atomi.
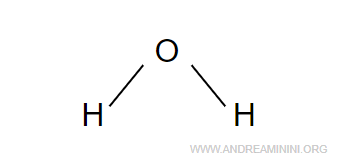
Non ci sono altre coppie di legame di aggiungere.
Gli elettroni non di legame degli atomi sono quattro
$$ EV - N \cdot 2 = 8 - 2 \cdot 2 = 4 $$
Gli atomi di idrogeno già soddisfano la regola del duetto perché ogni legame semplice è composto da due atomi.
All'atomo di ossigeno, invece, mancano quattro elettroni per raggiungere l'ottetto.
Quindi aggiungo gli elettroni rimanenti per completare l'ottetto nell'atomo di ossigeno.
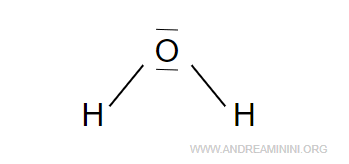
Esempio 2
Una molecola di acido nitroso HNO2 è composto da un atomo di idrogeno (H), un atomo di azoto (N) e due atomi di ossigeno (O).
L'idrogeno ha un elettrone di valenza, l'azoto ne ha 5 e l'ossigeno ne ha 6.
$$ EV = 1 + 5 + 6 \cdot 2 = 18 $$
Gli atomi necessari per soddisfare la regola dell'ottetto/duetto sono 26
$$ E* = 2 + 8 + 8 \cdot 2 = 26 $$
Quindi, la molecola è composta da 4 legami
$$ N = \frac{E*-EV}{2} = \frac{26-18}{2} = \frac{8}{2} = 4 $$
Scrivo i legami semplici tra gli atomi
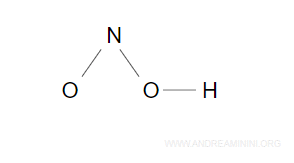
Ho scritto tre legami semplici, ne manca ancora uno da sistemare.
L'atomo di idrogeno già soddisfa il duetto. L'atomo di ossigeno con il legame all'azoto e all'idrogeno già soddisfa l'ottetto.
Quindi, l'ultimo legame devo aggiungerlo tra l'altro atomo di ossigeno e l'azoto trasformandolo in un doppio legame.
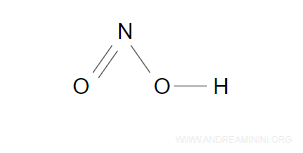
Gli elettroni rimanenti sono
$$ EV - N \cdot 2 = 18 - 4 \cdot 2 = 10 $$
Quindi le coppie solitarie ancora da sistemare sono 5.
Le sistemo intorno agli atomi per fare in modo che tutti soddisfini l'ottetto e il duetto nel caso dell'idrogeno.
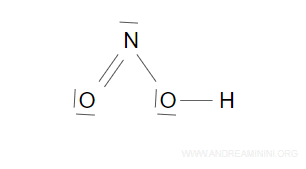
E così via.
