Gli atomi isotopi
Gli isotopi sono gli atomi che hanno lo stesso numero atomico ( numero di protoni ) dell'elemento chimico ma un numero di massa atomica ( numero di nucleoni ) differente.
Il numero dei neutroni negli isotopi è differente
La massa atomica ( A ) è determinata dalla somma dei protoni ( numero atomico Z ) e dei neutroni ( N ).
A = Z + N
Pertanto, gli isotopi sono atomi stabili che hanno lo stesso numero di protoni dell'elemento chimico ( Z ) ma un numero differente di neutroni ( N ).
Nonostante abbiano un numero diverso di protoni, gli isotopi hanno comunque un nucleo stabile.
Quando il nucleo è stabile? Il nucleo atomico è stabile quando il nucleo mantiene invariato il numero di nucleoni. Questa condizione si verifica soltanto in particolari rapporti Z / N .
Un esempio di isotopo
Il carbonio è un elemento chimico con numero atomico pari a 6 e un numero di massa pari a 12. Quindi, nel nucleo dell'atomo di carbonio ci sono sei protoni e sei neutroni.
Nel carbonio si presentano altre situazioni di stabilità quando il numero di massa è pari a 13, 14 e 15. Questi atomi sono detti isotopi.
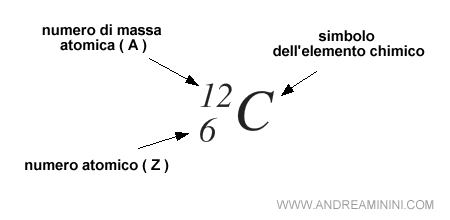
Come si indica un isotopo
La notazione più usata per indicare un isotopo è anteporre al simbolo dell'elemento chimico in alto a sinistra il numero di massa e in basso a sinistra il numero atomico.
Ad esempio, gli isotopi del carbonio possono essere scritti nel seguente modo:
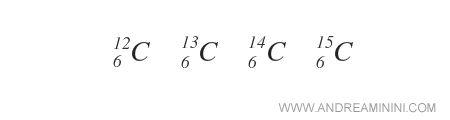
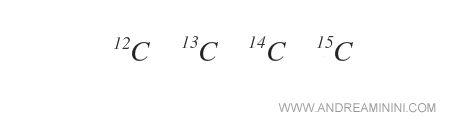
In alternativa, essendo il numero atomico sempre costante nell'elemento chimico, si può indicare soltanto il numero di massa in alto a sinistra.
Un'altra notazione molto utilizzata consiste nello scrivere il nome dell'elemento chimico seguito da un trattino e dal numero di massa. Ad esempio, carbonio-13 ( C-13 ), carbonio-14 ( C-14 ), carbonio-15 ( C-15 ).
