La configurazione elettronica di un atomo
Cos'è la configurazione elettronica dell'atomo
La configurazione elettronica dell'atomo è determinata dalla distribuzione dei suoi elettroni negli orbitali atomici.
A cosa serve
La configurazione elettronica è molto importante perché definisce il comportamento chimico dell'atomo.
Esempio. Gli elementi chimici che hanno lo stesso numero di elettroni nel livello più esterno ( elettroni di valenza ) hanno proprietà simili. In ogni atomo gli elettroni di valenza sono al massimo otto. Per questa ragione nella tavola periodica sono disposti nella stessa colonna nei gruppi degli elementi rappresentativi da I A a VIII A.
Le regole di distribuzione degli elettroni
La distribuzione degli elettroni intorno all'atomo segue tre regole:
- Regola 1
Gli elettroni occupano prima gli orbitali disponibili a minore energia. - Regola 2
Gli elettroni devono avere tutti i numeri quantici diversi (n,l,m,spin). - Regola 3 (regola di Hund)
Gli elettroni si dispongono con il massimo numero di spin paralleli quando occupano gli orbitali di pari energia (degeneri). E' detta regola di Hund (o principio della molteplicità).
Le regole di riempimento degli atomi
Un atomo può avere uno o più elettroni che orbitano intorno al suo nucleo.
Per conoscere il numero elettroni di un elemento chimico basta leggere il suo numero atomico (Z).
Regola 1
Gli elettroni occupano prima gli orbitali disponibili a minore energia.
Tutto ciò che esiste in fisica tende a uno stato di minore energia possibile. Gli elettroni non fanno eccezione.
Gli elettroni si dispongono prima sugli orbitali che richiedono minore energia, quelli più vicini al nucleo, e poi negli altri orbitali.
Cos'è un orbitale? E' una regione dello spazio intorno all'atomo in cui è molto probabile trovare gli elettroni.
Ogni atomo ha diversi orbitali.
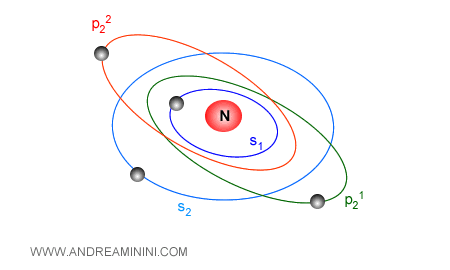
Ogni orbitale è caratterizzato da quattro numeri quantici.
- Il numero quantico principale (n)
E' il livello energetico dell'orbitale. Quanto più n è basso, tanto più l'orbitale è vicino al nucleo e richiede minore energia. Pertanto, i primi elettroni dell'atomo si dispongono sugli orbitali del primo livello energetico (n=1). Poi sugli altri. - Il numero quantico azimutale (l)
Questo parametro è un numero intero che definisce la forma dell'orbitale (s, p, d, f, g ). - Il numero quantico magnetico (m)
Questo parametro definisce l'orientazione dell'orbitale nello spazio. - Il numero quantico di spin
Indica la rotazione/polarità di un elettrone. Può assumere solo due valori.
L'ordine di riempimento degli orbitali è rappresentato in questa figura.
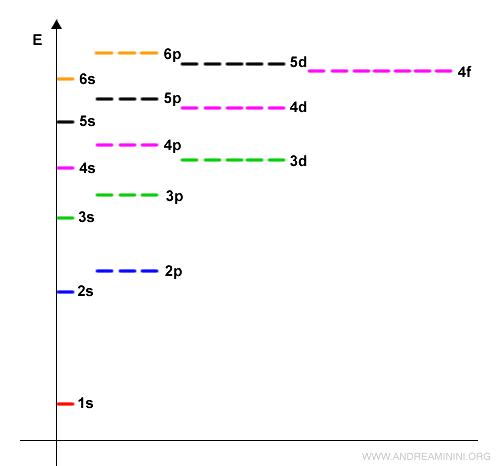
I primi orbitali a riempirsi sono quelli a minore energia che si trovano in basso ( 1s, 2s, 2p, 3s, ... ) e poi gli altri verso l'alto.
Nota. Il numero davanti all'orbitale indica il numero quantico principale (n) mentre la lettera che segue indica il numero quantico azimutale (s, p, d, f ) ossia la forma dell'orbitale. Per un approfondimento sulle regole di riempimento degli orbitali.
Regola 2
Gli elettroni devono avere tutti i numeri quantici diversi
Ogni elettrone ha quattro numeri quantici (n, l, m, spin).
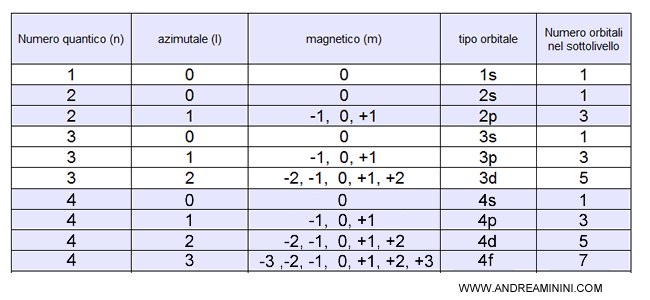
Poiché lo spin può assumere solo due valori, si deduce che ogni orbitale identificato dai valori n,l,m può ospitare solo due elettroni con spin opposto.
Questa regola è anche detta principio di Pauli o regola del doppietto elettronico.
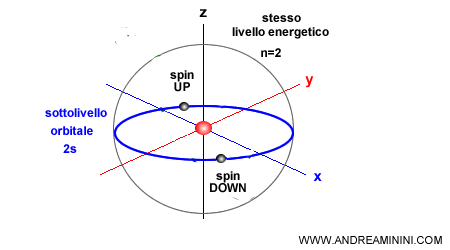
Regola 3 (Regola di Hund)
Quando gli elettroni occupano gli orbitali degeneri, quelli che hanno la stessa energia, si dispongono con il massimo numero di spin paralleli.
Questo principio è detto regola di Hund o regola della molteplicità.
Per spiegare questo concetto ricorro a un esempio pratico.
Esempio
L'atomo di ossigeno ha numero atomico Z=8. Quindi ha otto elettroni.
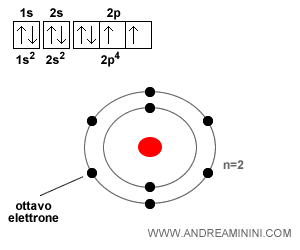
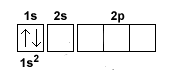
Nota. La configurazione elettronica può essere rappresentata in modo sintetico con un diagramma orbitale in cui ogni orbitale è rappresentato da un quadrato mentre le frecce indicano gli elettroni con spin opposto che ospita.
I primi due elettroni si dispongono sull'orbitale 1s a minore energia.
Per il principio di esclusione di Pauli, se gli elettroni sono sullo stesso orbitale (quadratino) devono avere lo spin opposto.
Quindi, un elettrone ha la freccia in su (UP) e l'altro i giu (DOWN).
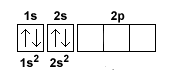
Il terzo e il quattro elettrone si dispongono sull'orbitale 2s perché il primo è ormai saturo.
Anche in questo caso gli elettroni hanno spin opposto (freccia up e down) perché si trovano sullo stesso orbitale.
Il quinto, il sesto e il settimo elettrone si dispongono sugli orbitali 3p.
Ogni elettrone occupa un orbitale diverso (quadratino) ma, secondo la regola di Hund, si dispone con spin parallelo rispetto al precedente, ossia con lo stesso verso della freccia.
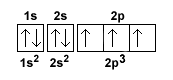
Nota. Quest'ultimo passaggio fornisce una spiegazione pratica della regola di Hund. I tre elettroni si dispongono sui tre orbitali (quadratini) di tipo 2p che hanno la stessa energia. Poiché sono tutti liberi, ogni elettrone occupa un orbitale diverso dagli altri. Un elettrone in ogni quadratino 2p. La polarità (spin) è però la stessa in ogni orbitale.
L'ottavo elettrone occupa il secondo posto ancora libero nel primo orbitale 3p.
Si dispone con spin opposto (freccia in basso) perché due elettroni non possono avere lo stesso spin in uno stesso orbitale.
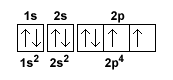
La configurazione elettronica superficiale
La configurazione elettronica superficiale è la disposizione degli elettroni di valenza sul livello energetico più esterno dell'atomo.
Si usa per rappresentare in modo sintetico la valenza dell'atomo senza scrivere tutti i sottolivelli interni della configurazione elettronica.
Esempio
Nel carbonio (C) il livello energetico più esterno è il secondo (n=2).
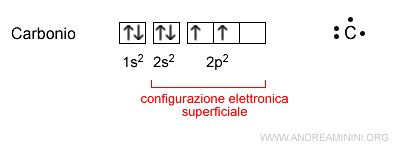
Gli elettroni di valenza si trovano soltanto sul livello energetico più esterno.
Pertanto, nella configurazione elettronica superficiale l'orbitale 1s può essere omesso.
Nota. L'utilità della configurazione elettronica superficiale cresce con il numero atomico. Negli elementi chimici con numero atomico elevato la configurazione elettronica superficiale permette di accorciare al minimo la rappresentazione degli orbitali che altrimenti diventerebbe molto lunga.
La configurazione elettronica degli elementi
Ecco un elenco completo della configurazione elettronica degli elementi allo stato fondamentale.
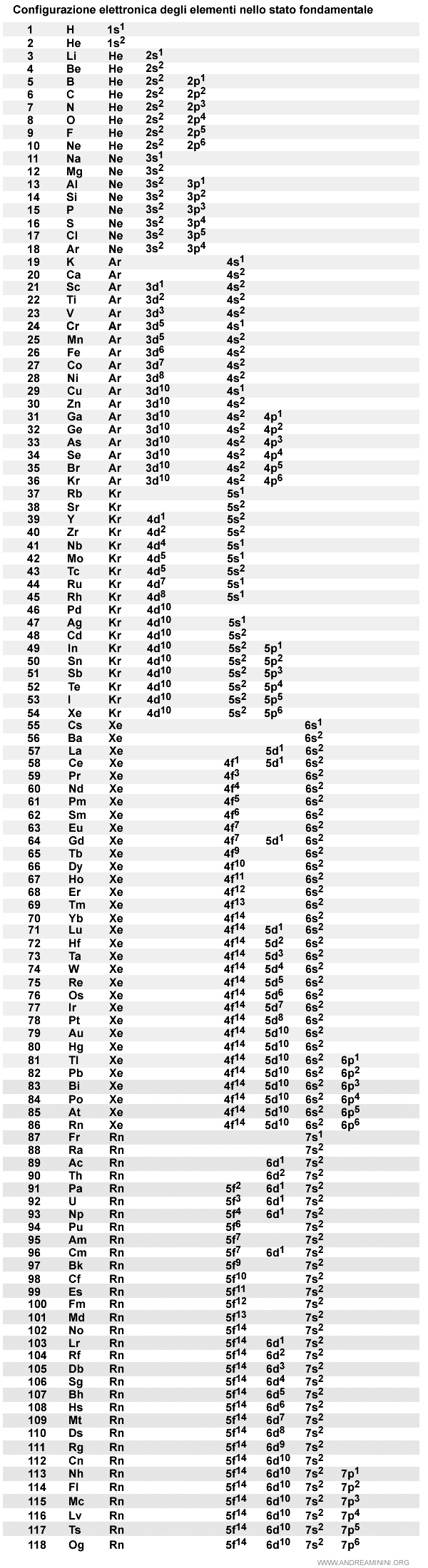
E così via.
