Energia di legame
Cos'è l'energia di legame
L'energia di legame è l'energia che tiene uniti gli atomi in un legame chimico oppure, in modo equivalente, l'energia necessaria per rompere un legame chimico portando gli atomi a distanza infinita. Per questa ragione è anche conosciuta come energia di dissociazione del legame. $$ AB \rightarrow A+B $$
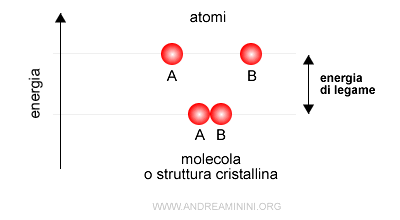
E' determinata dall'energia di ionizzazione e dall'affinità elettronica degli atomi del legame.
- L'energia di ionizzazione è l'energia necessaria per togliere un elettrone da un atomo.
- L'affinità elettronica è la tendenza di un atomo ad acquisire elettroni dall'esterno.
Nota. Si parla di "distanza infinita" perché è sicuramente una situazione in cui sicuramente non avvengono più interazioni attrattive o repulsive tra gli atomi. Si tratta di un concetto puramente teorico. In realtà, un legame si rompe quando gli atomi sono a una distanza sufficiente per evitare che ci siano altre interazioni reciproche tra gli atomi. Poiché questa distanza varia a seconda degli atomi, in teoria si usa l'astratto della "distanza infinita".
L'energia di legame varia da pochi a centina di kJ.
Si misura in kJ/mol ossia in kilo Joule per mole.
Esempio. L'energia di legame in una mole di ossigeno (O2) è di 498 kJ/mol mentre in una mole di azoto (N2) è di 941 kJ/mol.
Posso rappresentare graficamente l'energia di legame con la curva di Morse.
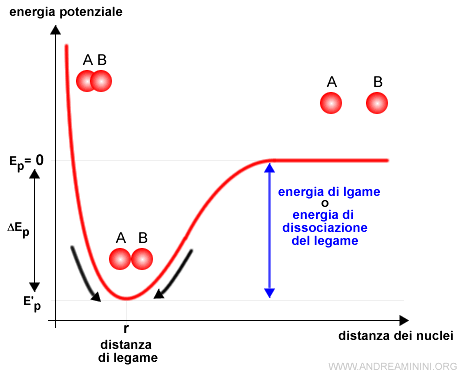
L'energia potenziale (Ep) varia con la distanza tra gli atomi.
- Quando i due atomi sono molto distanti ( distanza infinita ) l'energia potenziale è nulla Ep=0 perché la distanza tra i nuclei è eccessiva. Non ci sono interazioni di nessun tipo.
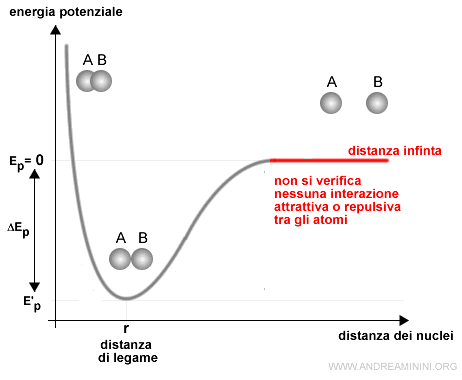
- A destra del punto r prevalgono le forze attrattive tra le particelle di carica opposta su quelle repulsive. L'interazione spinge gli atomi ad avvicinarsi.
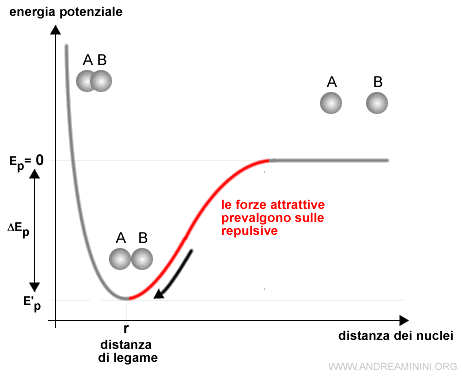
- A sinistra del punto r (distanza di legame) prevalgono le forze repulsive tra le particelle di uguale carica su quelle attrattive. L'interazione spinge gli atomi ad allontanarsi.
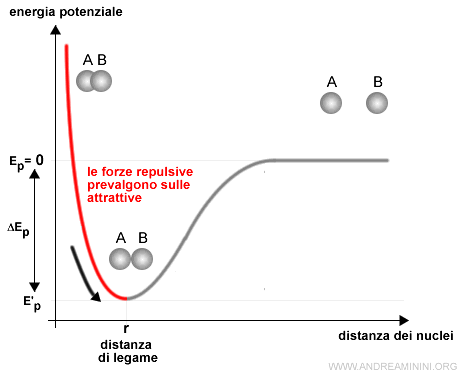
Alla distanza di legame il sistema è in equilibrio perché le forze repulsive e attrattive si bilanciano.
In equilibrio non c'è nessuna spinta al cambiamento. Quindi, il sistema è stabile.
La distanza di legame
La distanza di legame è la distanza media tra i nuclei di due atomi uniti da un legame chimico in una molecola o in un cristallo.
Si misura dal centro dei nuclei atomici.
Quando due atomi si avvicinano si pesentano due forze elettrostatiche opposte:
- Una forza attrattiva tra il nucleo di un atomo e gli elettroni dell'altro atomo
- Una forza repulsiva tra i due nuclei degli atomi e tra gli elettroni degli atomi

Nota. Il nucleo e gli elettroni hanno cariche elettriche opposte. I nuclei sono carichi positivamente mentre gli elettroni sono carichi negativamente.
Secondo la legge di Coulomb
L'intensità di una forza (F) tra due cariche elettriche q1 e q2 è direttamente proporzionale al prodotto delle cariche q1q2 e inversamente proporzionale al quadrato della distanza d2.
$$ F = \frac{q_1 \cdot q_2}{d^2} $$
Se la distanza reciproca tra gli atomi è troppo breve le forze repulsive prevalgono su quelle attrattive mentre se la distanza è eccessiva le forze attrattive sono troppo deboli per legare gli atomi.
Pertanto, per formare un legame chimico due atomi devono trovarsi a una distanza in cui le forze attrattive e le forze repulsive sono in equilibrio.
Questa distanza di equilibrio tra i nuclei degli atomi è la distanza di legame.
Quanto più la distanza di legame è corta, tanto più il legame è forte.
