Equazione di Schrödinger
Nella fisica atomica l'equazione di Schrödinger è una formula per descrivere la posizione e il moto degli elettroni intorno al nucleo, tramite una funzione d'onda.
Chi ha scritto l'equazione?
L'equazione è stata formulata per la prima volta nel 1926 dal fisico austriaco Erwin Schrödinger. Grazie a questo lavoro, nel 1933 lo scienziato ottenne il premio Nobel per la fisica.
Perché gli elettroni si muovono con una funzione d'onda
Secondo Schrödinger, le particelle subatomiche con carica negativa ( elettroni ) non occupano delle orbite circolari prestabilite intorno all'atomo.
Nell'atomo di Bohr l'elettrone segue un'orbita circolare. Tuttavia, il suo modello di riferimento è l'atomo di idrogeno che notoriamente ha un solo elettrone ( numero atomico uguale a uno ).
Il problema sorge quando l'atomo ha più elettroni. In questo caso, tra gli elettroni si interpone una forza di repulsione coulombiana ( forza di Coulomb ) che ne modifica le orbite.
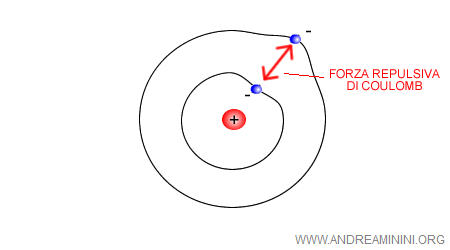
In conclusione, le orbite degli elettroni non possono essere determinate con le leggi della fisica classica.
Nota. Secondo le leggi della meccanica classica, a partire da determinate condizioni iniziali è sempre possibile descrivere la traiettoria di una particella mediante l'equazione del moto.
Inoltre, a causa del principio di indeterminazione di Heisenberg, in un sistema microscopico non è possibile nemmeno rilevare contemporaneamente la velocità e la posizione di una particella nella spazio.
Nota. L'atto stesso di osservare un elettrone mentre orbita intorno all'atomo influisce sulla sua posizione e sul suo moto. I fotoni della luce colpiscono gli elettroni e ne modificano la traiettoria.
La soluzione di Schrödinger: le onde di probabilità
Erwin Schrödinger propose di abbandonare ogni tentativo di misurazione degli elettroni con le leggi della meccanica classica e adottare un'interpretazione probabilistica tramite le leggi della meccanica quantistica.
Schrödinger elaborò un'equazione per calcolare le onde di probabilità, ossia le orbite intorno al nucleo ove l'elettrone potrebbe orbitare con maggiore probabilità.
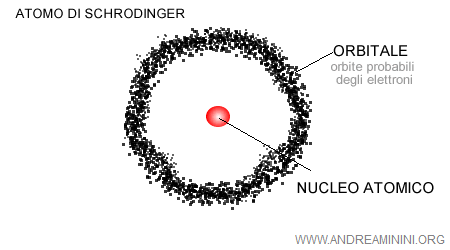
L'insieme delle onde di probabilità individua una regione dello spazio atomico, detta orbitale atomico, nella quale “probabilmente” si muovono gli elettroni.
Il paradigma dell'incertezza. Il lavoro di Schrödinger pose fine alla concezione ottocentesca della certezza nella fisica. Non era più possibile conoscere esattamente l'orbita delle particelle, era solo possibile immaginare in quali regioni dello spazio atomico potrebbero trovarsi.
Con l'equazione di Schrödinger venne abbandonata la rappresentazione dell'atomo come modello planetario di Niels Bohr. Nessuno poteva più confermare con certezza l'idea di Bohr dell'orbita circolare degli elettroni.
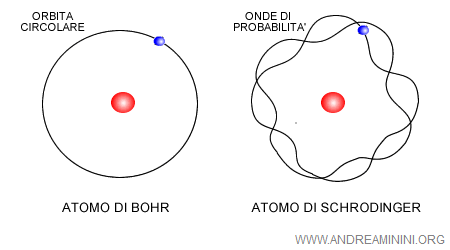
Piuttosto, l'atomo cominciò a essere immaginato come un nucleo circondato da regioni dello spazio atomico in cui si concentrano delle nubi elettroniche, ove si spostano gli elettroni.
Osservazioni degli utenti:
- Schrodinger non cercava onde di probabilita'. Questa interpretazione fu dovuta a Max Born.
30 / 01 / 2019
