Le regole di riempimento degli orbitali dell'atomo
La distribuzione degli elettroni negli orbitali di un atomo segue delle regole di riempimento. Secondo la meccanica quantistica queste regole sono essenzialmente due: la minima energia e il principio di esclusione.
La regola della minima energia
Quando un elettrone comincia a orbitare intorno al nucleo di un atomo, l'elettrone si sposta sul primo orbitale libero con un livello di energia più basso.
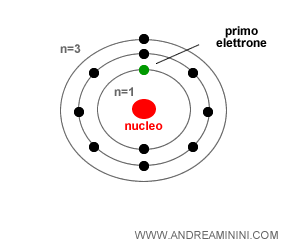
Pertanto, in un atomo quantistico gli elettroni occupano prima i livelli energetici più interni e più vicini al nucleo, purché liberi e disponibili.
Poi occupano progressivamente tutti gli altri orbitali più esterni.
Il principio di esclusione di Pauli
Secondo il fisico austriaco Pauli, in un atomo non possono esserci due elettroni con gli stessi numeri quantici. Questo enunciato è detto principio di esclusione.
I principali numeri quantici di una particella subatomica con carica elettrica negativa ( elettrone ) sono i seguenti:
- Il numero quantico principale ( livello energetico )
- Il numero quantico azimutale ( la forma dell'orbitale )
- Il numero quantico magnetico ( l'orientazione dell'orbitale o sottolivello )
- Il numero quantico di spin ( la rotazione della particella su se stessa )
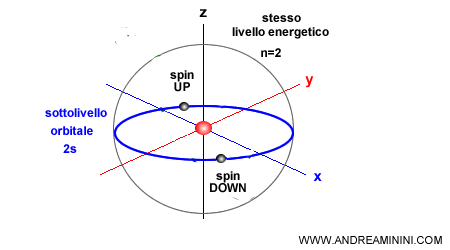
Da questa regola si deduce che sull'orbitale di qualsiasi sottolivello energetico possono esserci soltanto due elettroni con spin opposto. Un elettrone con spin UP e un altro elettrone con spin DOWN.
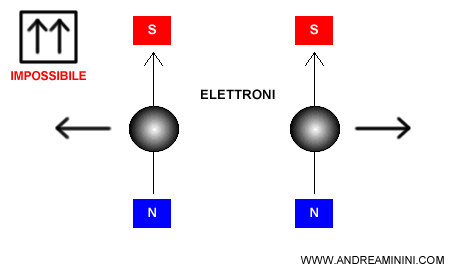
Perché lo spin deve essere opposto? Due elettroni con lo stesso spin ( es. Up+Up ) ruotano su se stessi nella stessa direzione e hanno la stessa polarità magnetica. Non possono trovarsi sullo stesso orbitale perché si respingono a vicenda come due calamite.
Un esempio pratico
L'atomo di idrogeno
L'atomo di idrogeno ha numero atomico pari a uno, quindi ha un solo elettrone.
Negli orbitali atomici, il primo posto libero con minore energia disponibile è quello più vicino al nucleo, sul primo livello energetico ( n=1 ).

Il primo livello energetico ha un solo orbitale di forma circolare detto 1s. L'elettrone comincia a orbitare sull'orbitale 1s con uno spin Up ( freccia verso l'alto ).
Nota. Il quadratino in alto a sinistra è detto diagramma orbitale. Ogni quadratino è un orbitale. Ogni freccia è un elettrone. Il verso della freccia indica lo spin (down o up) dell'elettrone sull'orbitale.
L'atomo di elio
L'atomo di elio ha un numero atomico pari a due, quindi ha due elettroni.
Il primo elettrone si colloca sull'orbitale 1s con spin Up, come già visto per l'atomo di idrogeno.
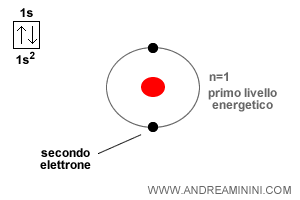
Anche il secondo elettrone si colloca sull'orbitale 1s2 ma con una rotazione opposta rispetto al primo ossia uno spin Down ( freccia verso il basso ).
L'atomo di litio
L'atomo di litio ha un numero atomico pari a tre ( Z=3 ) e, pertanto, ha tre elettroni. I primi due elettroni si collocano sull'orbitale 1s come l'atomo di elio.
Il terzo elettrone non può orbitare sull'orbitale 1s perché non ci sono più posizioni disponibili. Ogni orbitale può ospitare al massimo due elettroni con spin opposto.
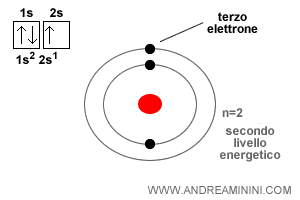
Quindi, il terzo elettrone deve spostarsi sulla prima posizione libera sul secondo livello energetico ( n=2 ).
Nota. Il secondo livello energetico ha quattro sottolivelli, un orbitale circolare ( 2s ) e tre orbitali ellittici ( 2p1, 2p2, 2p3 ). In tutto può ospitare otto elettroni.
Essendo il primo elettrone a inserirsi sul secondo livello energetico, occupa la prima posizione nell'orbitale circolare ( 2s1 ) con spin Up.
L'atomo di berillio
L'atomo di berillio ha quattro elettroni, i primi tre elettroni occupano le stesse posizioni dell'atomo di litio.
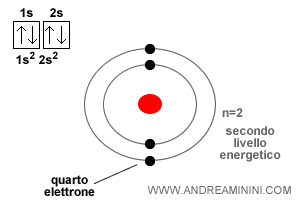
Il quarto elettrone si colloca sull'orbitale circolare ( 2s ) del secondo livello energetico ma con spin Down.
L'atomo di boro
L'atomo di boro ha cinque elettroni. I primi quattro elettroni si dispongono allo stesso modo dell'atomo di berillio.
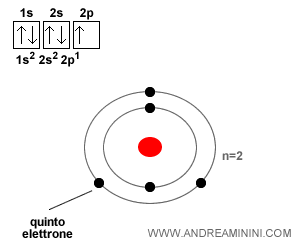
Il quinto elettrone si sposta sul primo orbitale ellittico ( 2p1 ) del secondo livello energetico con spin Up.
L'atomo di carbonio
L'atomo di carbonio ha sei elettroni. Il sesto elettrone si sposta sul secondo orbitale ellittico ( 2p2 ) del secondo livello energetico ( n=2 ) con spin Up.
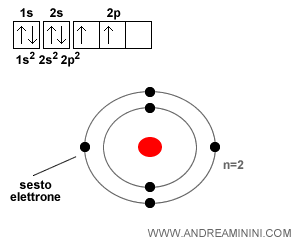
Nota. Quando ci sono più orbitali non circolari, gli elettroni riempiono prima tutti i sottolivelli con spin Up e poi le posizioni sugli stessi con spin Down.
L'atomo di azoto
L'atomo di azoto ha sette elettroni. Quindi, il suo numero atomico è pari a sette. I primi sei sappiamo già come si posizionano.
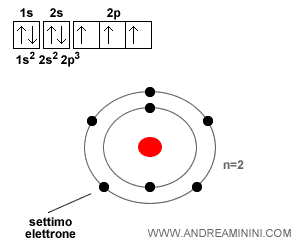
Il settimo elettrone si sposta sul terzo orbitale ellittico ( 2p3 ) del secondo livello energetico ( n=2 ) con spin Up.
L'atomo di ossigeno
L'atomo di ossigeno ha otto elettroni. Non ci sono più sottolivelli completamente liberi sul secondo livello energetico, sono tutti semipieni.
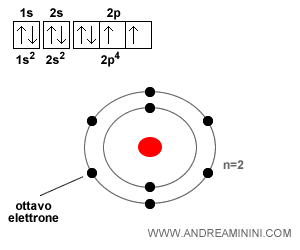
L'ottavo elettrone si colloca sul primo orbitale ( 2p4 ) del secondo livello energetico con spin Down, perché la prima posizione Up è già occupata.
L'atomo di fluoro
L'atomo di fluoro ha nove elettroni. Il nono elettrone si sposta sul secondo orbitale ( 2p5 ) del secondo livello energetico con spin Down.
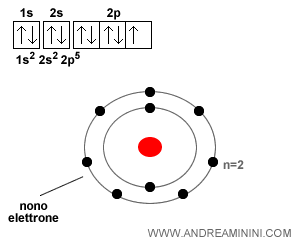
L'atomo di neon
L'atomo di neon ha dieci elettroni. Il decimo elettrone si posiziona sul terzo orbitale ( 2p6 ) del secondo livello energetico con spin Down.
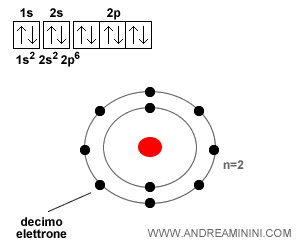
L'atomo di sodio
L'atomo di sodio ha undici elettroni. Non ci sono più posti disponibili nei sottolivelli del secondo livello energetico.
L'undicesimo elettrone si sposta sul terzo livello energetico ( n=3 ) dove è disponibile un orbitale sferico ( 3s ), tre orbitali di tipo 3p e cinque orbitali di tipo 3d. In tutto, sono nove sottolivelli per un totale di diciotto elettroni.
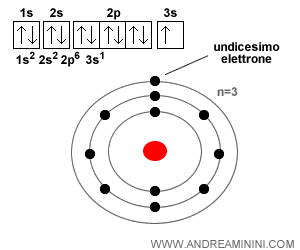
Essendo il primo elettrone a collocarsi sul terzo livello energetico ( n=3 ), l'elettrone si colloca sull'orbitale sferico 3s1 con spin Up. E così via.
