Orbitali atomici
Cosa sono gli orbitali di un atomo
Gli orbitali sono regioni dello spazio intorno al nucleo dell'atomo dove è alta la probabilità di trovare un elettrone.
Ogni orbitale è una regione dello spazio individuata da una formula matematica ed è definito dai numeri quantici n, l, m.
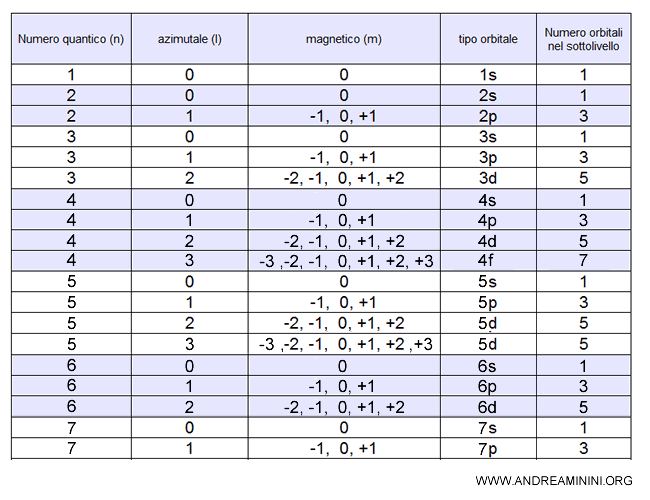
- Il numero quantico principale (n) è un numero intero che definisce il livello energetico dell'elettrone e la dimensione dell'orbitale.
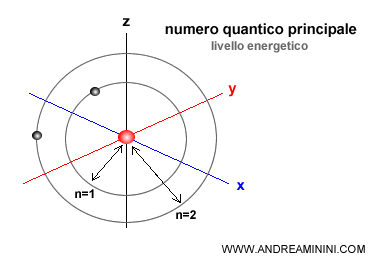
Nota. Il livello più basso (n=1) è quello più vicino al nucleo e con energia minore. Man mano che il livello aumenta (n=2,3,4,...) la regione di spazio si allontana dal nucleo ed ha energia maggiore.
- Il numero quantico secondario o azimutale (l) identifica i sottolivelli di ogni livello. E' un numero intero compreso tra 0 e n-1 ed è indicato con una lettera minuscola (s=0, p=1, d=2, f=3, g=4). Ogni sottolivello è una particolare forma dell'orbitale nello spazio.
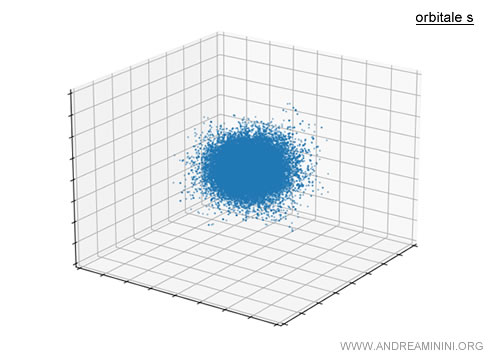
Perché gli orbitali si chiamano s, p, d, f? Gli scienziati che per primi studiarono gli spettri atomici classificarono le righe spettrali con i nomi sharp (nette), principal (principali), diffuse (diffuse) e fundamental (fondamentali) dalle cui lettere iniziali derivano gli acronimi s, p, d, f. A ciascuna di queste corrisponde rispettivamente il valore del numero quantico secondario (0,1,2,3). Ecco un esempio di orbitale di tipo s che ha la forma tipicamente sferica.
In realtà, si tratta di una semplificazione. Un orbitale è più simile a una nuvola di punti in cui è probabile che passi un elettrone durante la sua orbita.
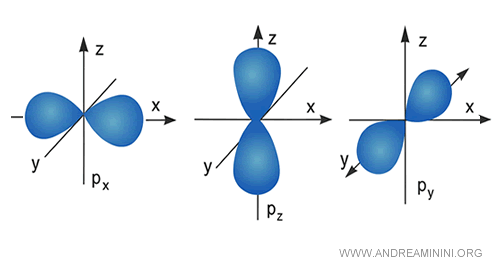
Gli altri orbitali di tipo p, d, f hanno invece forme più elaborate composti da più lobi che a volte somigliano a dei fiori, altre volte a delle ciambelle toroidali. - Il numero quantico magnetico (m) definisce il numero di orbitali in ciascun sottolivello e il loro orientamento nello spazio. Sono indicati con un numero intero da -l a l incluso lo zero. Gli orbitali di un sottolivello hanno tutti la stessa energia, pertanto sono detti degeneri.
Esempio. Il sottolivello p ha numero quantico azimutale pari a l=1. Quindi, ha tre orbitali m=-1, 0, +1 degeneri. Ogni orbitale è orientato su un asse cartesiano dello spazio. Ecco come vengono solitamente rappresentati nei libri di chimica gli orbitali di tipo $ p $.
Esempio. Gli orbitali del sottolivello di tipo $ d $ compaiono a partire dal terzo livello energetico principale (n = 3). Sono le regioni dello spazio dove è più probabile trovare un elettrone. Corrispondono al numero quantico azimutale $ l = 2$, quindi ci sono cinque orbitali distinti $ m=-2,-1,0,1,2 $ oltre ai precedenti di tipo s e p. Questi sono: $d_{xy}$, $d_{xz}$, $d_{yz}$, $d_{x^2 - y^2}$, $d_{z^2}$.
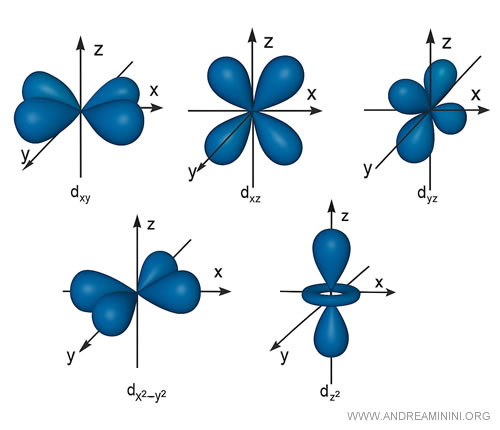
I primi quattro ( $d_{xy}, d_{xz}, d_{yz}, d_{x^2 - y^2}$ ) hanno quattro lobi orientati tra gli assi o lungo gli assi cartesiani, e somigliano a quattro petali di un fiore (forma detta a "croce"). L'orbitale $d_{z^2}$ ha, invece, due lobi verticali lungo l'asse z e un toroide centrale a forma di ciambella intorno all’equatore. Ogni orbitale può contenere al massimo 2 elettroni (con spin opposto). Quindi, essendoci 5 orbitali d per 2 elettroni ciascuno, complessimvamente ci possono essere 10 elettroni al massimo per ogni sottolivello d. A causa dell'interazione tra i livelli energetici, gli orbitali $3d$ sono energeticamente superiori ai 4s, quindi si riempiono dopo i 4s nella configurazione elettronica.
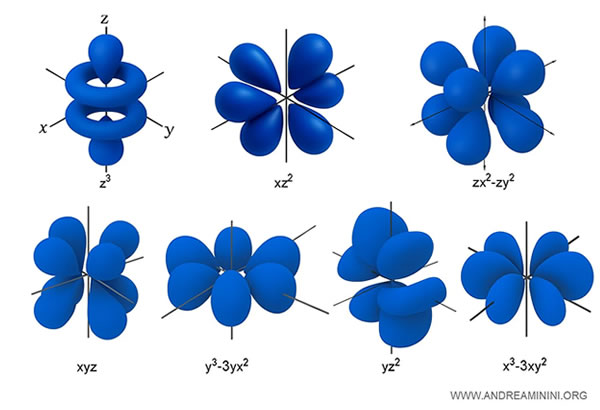
Esempio. Gli orbitali di tipo $ f $ hanno forme particolarmente complesse e simmetriche, spesso caratterizzate da lobi multipli orientati nello spazio in modo elaborato. Corrispondono al numero quantico azimutale $l = 3$, e quindi esistono sette orbitali distinti, con $m = -3, -2, -1, 0, 1, 2, 3$, oltre a tutti quelli di tipo s, p e d già presenti nei livelli inferiori. Questi orbitali iniziano a comparire a partire dal quarto livello energetico ($n \geq 4$).
Complessivamente i primi livelli energetici sono caratterizzati dalle seguenti combinazioni di numeri quantici.
Il principio di esclusione di Pauli
Secondo il principio di esclusione, in un orbitale gli elettroni devono avere spin opposto l'uno dall'altro.
Di conseguenza ogni orbitale può ospitare al massimo due elettroni (doppietto elettronico).
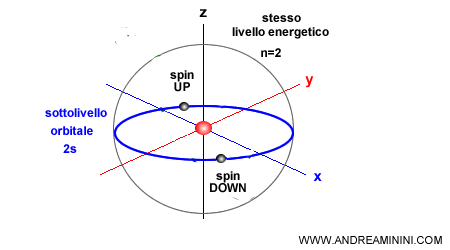
Cos'è lo spin? Il numero quantico di spin definisce la rotazione/polarità dell'elettrone. Può assumere i valori +1/2 e -1/2.
Le regole di riempimento degli orbitali
In un atomo si riempiono prima i livelli energetici più vicini al nucleo.
L'orbitale più vicino al nucleo è il livello energetico n=1 di tipo s.
Poiché un orbitale può ospitare al massimo due elettroni, i primi due elettroni si collocano nel livello s1.
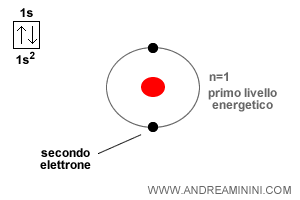
I successivi elettroni si collocano nel livello energetico successivo n=2.
Prima nell'orbitale sferico di tipo 2s
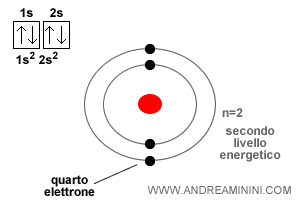
Poi negli orbitali di tipo 2p
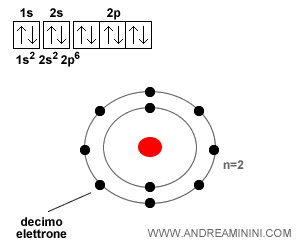
Quando tutti i posti di un orbitale sono occupati, l'orbitale è saturo e si passa al successivo.
Tuttavia, non è detto che una volta saturo un sottolivello si passi al successivo. Potrebbero esserci anche dei salti in avanti tra i livelli energetici.
Gli elettroni occupano l'orbitale a minore energia tra quelli disponibili.
In questo grafico sono visualizzate le energie dei sottolivelli (s,p,d,f) nei primi n=7 livelli energetici.
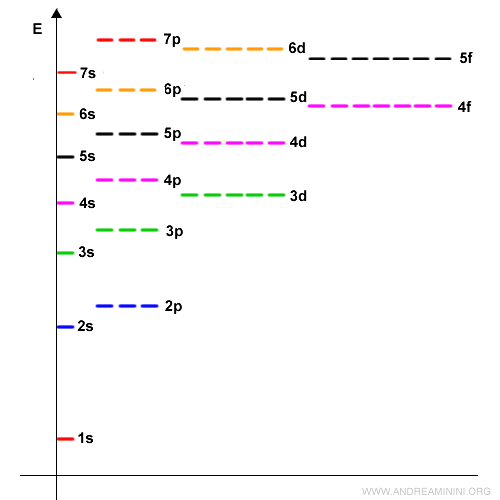
Come si può notare, dopo gli orbitali 3p non seguono gli orbitali 3d perché l'orbitale 4s richiede minore energia.
Quindi, una volta saturo il sottolivello 3p gli elettroni cominciano a riempire l'orbitale 4s. Una volta saturo 4s passano all'orbitale 3d.
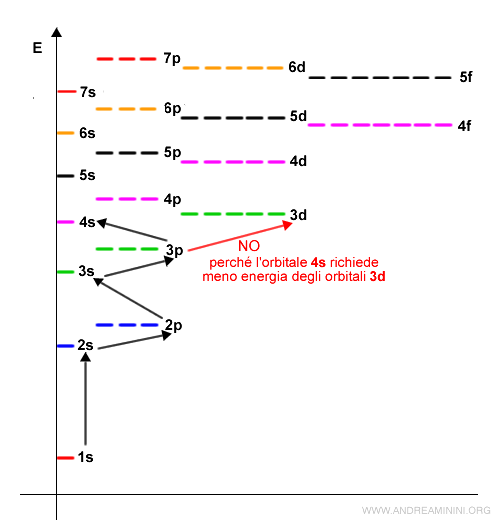
L'ordine di riempimento degli orbitali è
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
A partire dal livello energetico n=3 si verificano diversi salti in avanti e indietro.
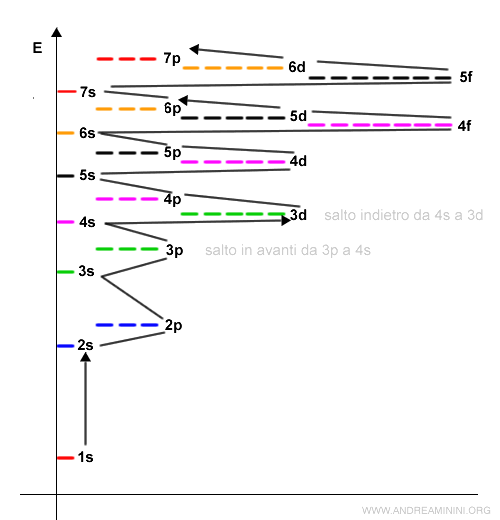
Nota. L'orbitale 7p è l'ultimo a essere occupato da un atomo in base alle attuali conoscenze scientifiche che arrivano fino all'elemento chimico sintetico Organesson (Og) con numero atomico Z=118. Teoricamente, dopo l'orbitale 7p si passa all'orbitale 8s ancora non utilizzato e la sequenza continua su orbitali ancora più esterni di tipo g, h, i. Dopo 7p la sequenza teorica degli orbitali continua in questo modo 8s, 5g, 6f, 7d, 8p, 9s
Ovviamente non è facile ricordare a memoria tutta la sequenza.
Tuttavia, c'è un metodo logico che aiuta a ricostruire rapidamente la sequenza di riempimento degli orbitali.
In questo schema dispongo nelle prime quattro colonne i sottolivelli energetici (s, p, d, f).
Ogni riga, invece, identifica un livello energetico (1,2,3,4,5,6,7,...).
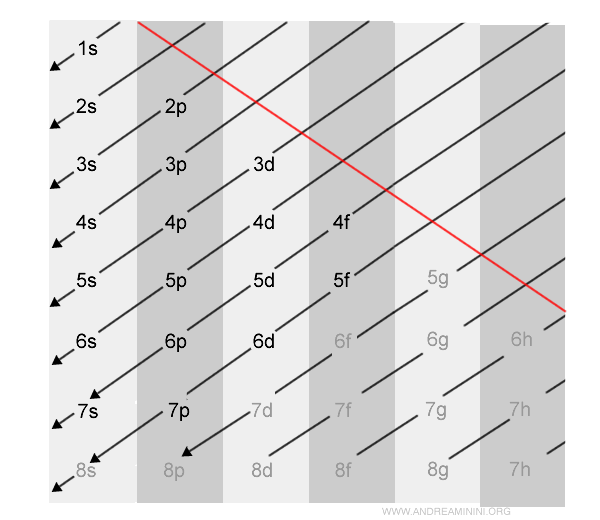
Nota. Gli orbitali con colore marcato fino all'orbitale 7p sono quelli occupati dagli atomi in base all'attuale conoscenza umana. Gli orbitali con colore più chiaro (es. 8s, 5g, 6f, 8p, ...) sono orbitali teorici più esterni non ancora usati nella configurazione elettronica degli elementi chimici.
Seguendo le frecce diagonali a partire dall'angolo in alto a sinistra verso il basso ottengo la sequenza di riempimento degli orbitali.
E così via.
