Principio di Pauli
Cosa afferma il principio di Pauli
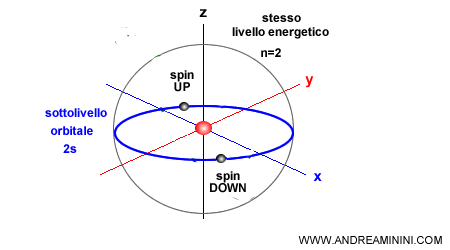
Due elettroni possono occupare lo stesso orbitale soltanto se hanno spin opposto.
E' anche detto principio di esclusione, perché esclude la possibilità che due elettroni condividano lo stesso stato quantico.
Poiché lo spin può assumere solo due valori (up o down), ne consegue che in qualsiasi orbitale atomico possono trovarsi al massimo due elettroni.
Per questa ragione, il principio di Pauli è anche conosciuto in modo informale come regola del doppietto elettronico.
E' una delle regole fondamentali della configurazione elettronica di un atomo.
Cos'è lo spin? Lo spin è uno dei numeri quantici fondamentali dell’elettrone, associato a una proprietà intrinseca della particella, che può assumere due valori: spin up (+ ½) e spin down (− ½). Sebbene venga talvolta descritto come una rotazione su se stesso (o polarità), si tratta di una proprietà puramente quantistica, senza un analogo classico diretto.
In generale, il principio di esclusione di Pauli si applica ai fermioni, ossia a particelle con spin semi-intero che occupano stati quantici anti-simmetrici.
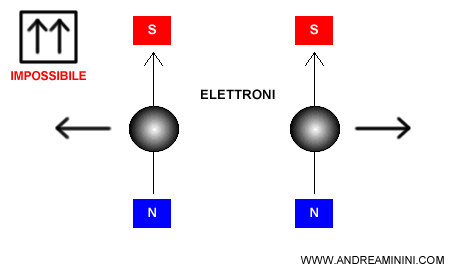
Due fermioni identici non possono occupare simultaneamente lo stesso stato quantico
Di conseguenza, oltre che agli elettroni, il principio di Pauli riguarda anche protoni, neutroni e altre particelle appartenenti alla famiglia dei fermioni.
Questo principio è stato formulato dal fisico austriaco Wolfgang Pauli nel 1925 ed è uno dei principi fondamentali della mceccanica quantistica.
Un esempio pratico
L'atomo di litio ha numero atomico Z=3.
Quindi, ha tre elettroni.
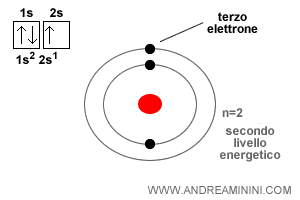
I primi due elettroni si dispongono nell'orbitale sferico più interno dell'atomo (1s) sul livello energetico n=1, quello a energia più bassa.
Il terzo elettrone si colloca sull'orbitale sferico appena più esterno (2s) sul livello energetico n=2.
In un atomo, gli elettroni occupano prima gli orbitali a energia più bassa, per poi riempire progressivamente quelli a energia più alta.
Nota. Nel diagramma orbitale ogni quadratino indica un orbitale. Le frecce, invece, indicano gli elettroni. Il verso della freccia rappresenta lo spin up o down. Quindi, nello stesso orbitale non possono esserci due frecce in su (up) o due frecce in giù (down).
Esempio 2
L'atomo di berillio ha numero atomico Z=4.
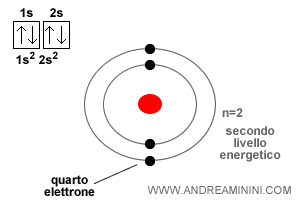
I primi due elettroni del berillio occupano l’orbitale 1s, il più interno e a minore energia, mentre il terzo si colloca nell’orbitale 2s, più esterno, esattamente come nel litio.
Il quarto elettrone si posiziona sul secondo orbitale, dove c'è ancora un posto vuoto, ma con lo spin opposto rispetto al terzo elettrone, quello che già si trova sull'orbitale.
Questo è possibile proprio in virtù del principio di esclusione di Pauli: uno stesso orbitale può contenere al massimo due elettroni con spin opposti.
E così via.
