Il raggio atomico
Il raggio atomico è la distanza tra il nucleo dell'atomo e l'ultimo orbitale più esterno.
Ogni elemento chimico ha un proprio raggio atomico.
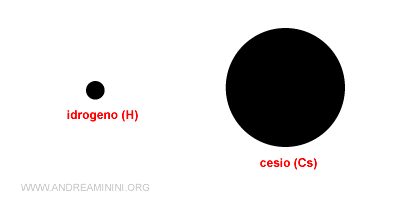
Ad esempio, l'idrogeno (H) ha un raggio pari a 27·10-12 m mentre il cesio (Cs) è circa 267·10-12 m, ossia è dieci volte più grande.
Come si misura il raggio atomico
Per misurare il raggio atomico si considera la metà della distanza tra i nuclei di due atomi uguali e adiacenti in una molecola solida o gassosa.
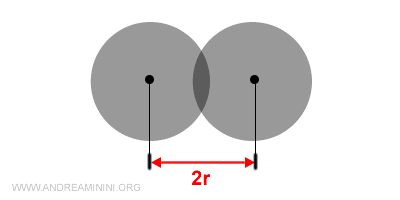
I confini di un atomo sono delimitati dall'orbitale più esterno ma non sono definiti in modo certo.
Per questa ragione si utilizza un valore medio.
Il raggio atomico varia con il periodo
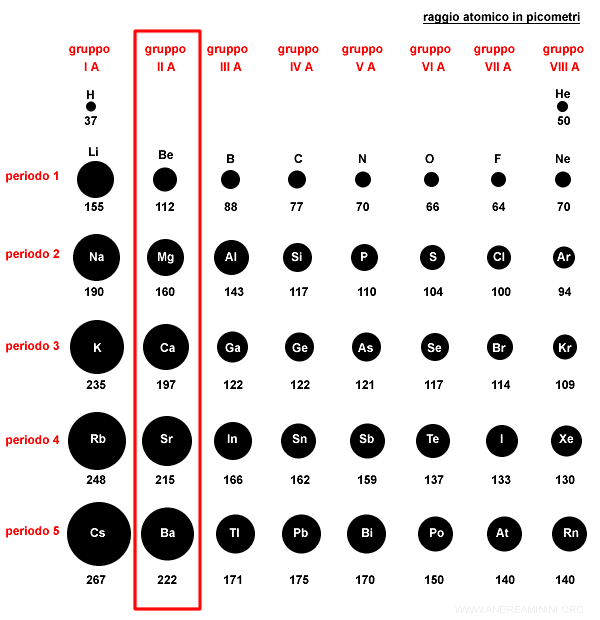
Nella tavola periodica il raggio atomico tende a crescere con il periodo all'interno di uno stesso gruppo per effetto del livello energetico più esterno.
Spiegazione
A parità di gruppo, gli elementi chimici su un periodo più alto hanno un raggio atomico maggiore, perché gli elettroni si dispongono sugli orbitali di un livello energetico più esterno (numero quantico principale).
Nei livelli energetici più esterni il volume atomico è maggiore.
Pertanto, il raggio atomico è più alto.
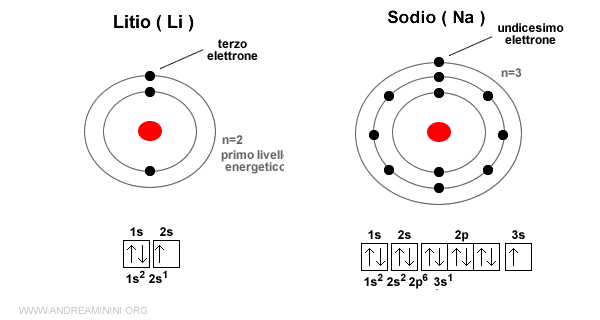
Esempio. Il litio (li) e il sodio (Na) si trovano sullo stesso gruppo I A ma su periodi diversi. Il litio è nel periodo 2 mentre il sodio è nel periodo 3. L'ultimo elemento del sodio si colloca sul livello energetico n=3 ossia su un orbitale più esterno. Per questa ragione il raggio atomico del sodio (190 pm) è maggiore del litio ( 155 pm ).
Il raggio atomico varia con il gruppo
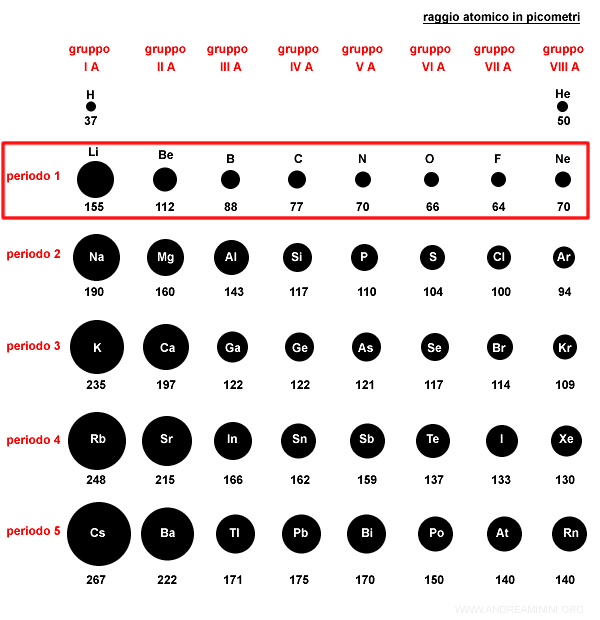
Nella tavola periodica il raggio atomico tende a diminuire con i gruppi di uno stesso periodo da sinistra verso destra per effetto della maggiore forza di attrazione del nucleo.
Pertanto, gli elementi nei primi gruppi hanno un raggio atomico maggiore rispetto agli ultimi gruppi.
Spiegazione
Nello stesso periodo gli elettroni si dispongono sugli orbitali dello stesso livello energetico.
Tuttavia, gli elementi nei primi gruppi principali hanno meno protoni ed elettroni rispetto agli ultimi gruppi. Il numero atomico (Z) è più basso.
Quindi, la forza di attrazione dei protoni nel nucleo sugli elettroni è minore.
Di conseguenza la nube elettronica è più estesa e il raggio atomico è maggiore.
Nota. Viceversa, negli ultimi gruppi principali del periodo il numero di protoni ed elettroni è maggiore a parità di livello energetico. Pertanto, la forza di attrazione verso il nucleo è maggiore, la nube elettronica si avvicina al nucleo e il raggio atomico è minore.
Le variazioni del raggio atomico
Le variazioni del raggio atomico sono maggiori nei primi gruppi e minori spostandosi verso destra in uno stesso periodo a causa della forza repulsiva degli elettroni.
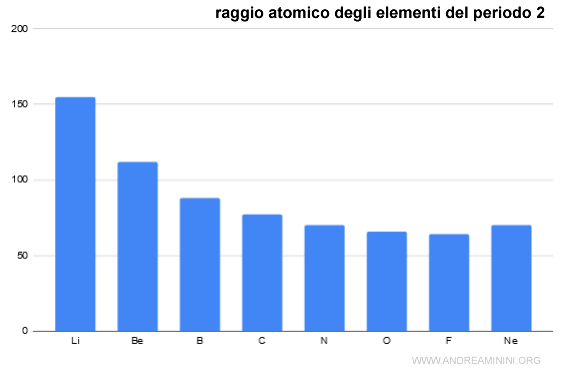
Esempio
Nel periodo 2 la riduzione del raggio atomico è molto marcata dal litio (Z=3) al Berillio (Z=4).
Negli elementi successivi si riduzione diventa sempre più piccola.
Spiegazione
In uno stesso periodo gli elettroni si dispongono sullo stesso livello energetico (numero quantico principale).
Sulla tavola periodica il numero di elettroni degli elementi cresce spostandosi da sinistra verso destra.
Quindi, gli elementi dei gruppi più a destra devono disporre una maggiore quantità di elettroni sullo stesso livello energetico (stesso periodo).
A parità di spazio, la densità degli elettroni è maggiore.
Esempio. Litio e neon sono due elementi del periodo 2. Quindi il livello energetico è lo stesso (n=2). Il litio si trova nel gruppo IA e ha tre elettroni (Z=3) mentre il neon si trova nel gruppo VIII A e ha dieci elettroni (Z=10). Nel caso del neon la densità degli elettroni è maggiore.
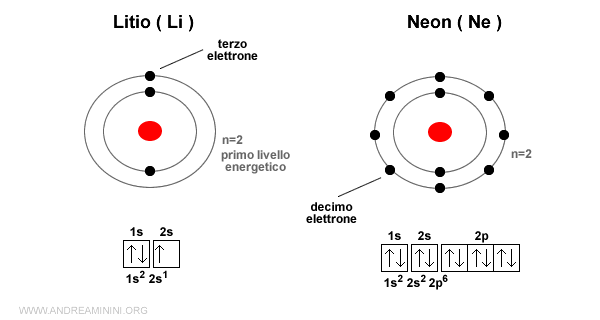
Gli elettroni sono più vicini e si respingono reciprocamente perché hanno tutti la stessa carica negativa.
La forza repulsiva degli elettroni si oppone alla forza di attrazione del nucleo.
Per questo motivo le variazioni del raggio atomico sono maggiori nei primi gruppi e via via più contenute spostandosi verso destra.
Nota. Negli elementi dei gruppi di transizione si riempiono progressivamente gli orbitali di tipo d, più interni rispetto agli orbitali di tipo s. La maggiore densità di elettroni tende a respingere gli elettroni di valenza più esterni, riducendo la forza di attrazione del nucleo.
Il raggio ionico
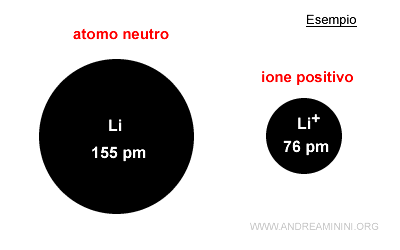
Negli ioni positivi o negativi il raggio atomico è detto raggio ionico.
Il raggio atomico è più ampio in uno ione negativo (anione) e meno ampio in uno ione positivo (catione) rispetto all'atomo neutro.
La spiegazione
- Ione positivo
Uno ione positivo è un atomo con carica positiva perché la quantità di protoni nel nucleo è superiore a quella degli elettroni. Il nucleo ha una forza di attrazione maggiore rispetto a un atomo stabile. La nuvola elettronica si avvicina al nucleo, il volume atomico si contrae e il raggio atomico si riduce.
- Ione negativo
Uno ione negativo è un atomo con carica negativa, perché la quantità degli elettroni è superiore a quella dei protoni nel nucleo. Il nucleo ha minore forza di attrazione mentre gli elettroni hanno maggiore forza repulsiva rispetto a un atomo neutro. Queste ultime due forze causano l'espansione della nuvola elettronica verso l'esterno, aumentando il raggio atomico.
Nota. Il raggio ionico segue le stesse indicazioni del raggio atomico, cresce all'aumentare del periodo negli atomi appartenenti allo stesso gruppo. Inoltre, mostrano variazioni regolari al variare del numero atomico nello stesso periodo.
E così via.
