Elettronegatività
Cos'è l'elettronegatività
L'elettronegatività è una proprietà chimica che misura la capacità di un atomo in una molecola di attrarre gli elettroni di legame.
Quanto più è alta l'elettronegatività di un atomo, tanto più è in grado di attrarre gli elettroni di legame.
L'elettronegatività permette anche di capire il tipo di legame chimico (covalente o ionico) che si forma tra gli atomi.
Nota. L'opposto dell'elettronegatività è l'elettropositività.
Quali sono le cause dell'elettronegatività
L'elettronegatività dipende essenzialmente da due fattori:
- la configurazione elettronica dell'elemento
- la dimensione atomica
Nota. Il valore di elettronegatività di un elemento chimico è determinato dalla sua energia di ionizzazione e affinità elettronica.
La scala di Pauling
L'elettronegatività è una grandezza adimensionale misurata tramite una scala detta scala di Pauling.
Nel 1932 L.Pauling ideò una scala relativa per misurare l'elettronegatività sulla base dei valori sperimentali delle energie di legame delle molecole.
Nella scala di Pauling viene adottato come riferimento l'idrogeno a cui è assegnato originariamente un valore di elettronegatività pari a 2,1
Esempio. L'idrogeno (H) ha un'elettronegatività di 2,1 nella scala di Pauling mentre l'ossigeno (O) ha un'elettronegatività di 3,5. Pertanto, l'ossigeno possiede una maggiore capacità di attrarre gli elettroni di legame rispetto all'idrogeno.
Successivamente il valore di elettronegatività dell’idrogeno è stato rivisto e portato a 2,2, che rappresenta il valore oggi adottato come riferimento.
Oggi tutti gli elementi chimici hanno un valore di elettronegatività compreso tra 0,70 e 3,98.
Il ragionamento di Pauling
In una molecola omonucleare biatomica ogni atomo contribuisce alla metà dell'energia di legame.
Quindi, in una molecola omonucleare A2 tra due atomi uguali, ogni atomo contribuisce alla metà del valore dell'energia di legame EA-A.
Non accade lo stesso nelle molecole eteronucleari (es. AB), tra atomi diversi A e B, dove ogni atomo contribuisce in modo diverso all'energia di legame EA-B.
Per risolvere il problema Pauling considerò l'energia di legame covalente EA-B tra gli atomi diversi come la media geometrica delle energie di legame dei due atomi EA-A e EB-B misurate nelle rispettive molecole omonucleari (A2 e B2).
$$ E_{A-B} = \sqrt{E_{A-A} \cdot E_{B-B}} $$
Tuttavia, questo valore non coincide con l'energia di legame EA-B* misurata sperimentalmente.
La differenza tra il valore misurato sperimentalmente e quello calcolato per il legame covalente puro
$$ D = E_{A-B}* - E_{A-B} $$
è tanto maggiore, quanto più alta è la differenza di elettronegatività tra gli atomi A e B.
Pauling misurò empiricamente la correlazione con questa formula
$$ |x_A - x_B| = 0,102 \sqrt{D} $$
Dove xA e xB sono le elettronegatività degli atomi A e B.
L'elettronegatività degli elementi chimici
L'elettronegatività cresce con il numero atomico negli elementi di uno stesso periodo e diminuisce nel periodo successivo negli elementi di uno stesso gruppo.

Pertanto, nella tavola periodica l'elettronegatività aumenta spostandosi da sinistra verso destra e dal basso verso l'alto.
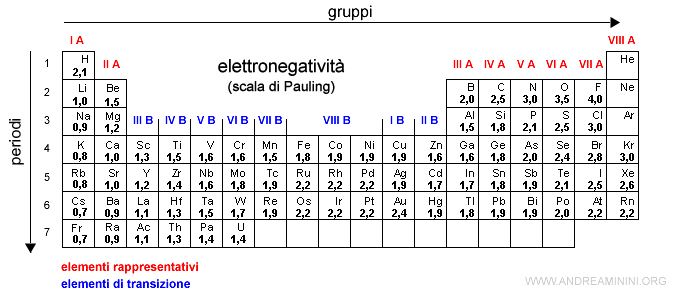
In un periodo l'elettronegatività cresce con il numero atomico perché cresce la carica nucleare per elettrone ossia la forza di attrazione.
Nota. Al crescere del numero atomico in un periodo crescono sia i protoni che gli elettroni. Tuttavia, gli elettroni si dispongono sullo stesso livello energetico ossia nello stesso spazio. Quindi, sono maggiormente sottoposti alla crescente forza di attrazione del nucleo.
In un gruppo l’elettronegatività diminuisce al crescere del periodo perché gli elettroni di valenza occupano livelli energetici sempre più esterni, aumentando il raggio atomico e riducendo l’attrazione esercitata dal nucleo.
Essendo più lontani, gli elettroni negli orbitali più esterni risentono meno della forza attrattiva dei protoni.
Nota. L'elemento chimico più elettronegativo è il fluoro (F) con 4,0. E' seguito dall'ossigeno (O) con 3,5 e dall'azoto (N) e cloro (Cl) con 3,0. L'elemento meno elettronegativo è il cesio (Cs) con 0,7.

La differenza tra elettronegatività e affinità elettronica
L'elettronegatività si distingue dall'affinità elettronica.
- L'affinità elettronica è una grandezza di un atomo isolato.
- L'elettronegatività è, invece, una grandezza di un atomo legato ad altri atomi.
A cosa serve conoscere l'elettronegatività
La conoscenza dei valori di elettronegatività degli atomi mi permette di capire se il legame chimico è di tipo ionico oppure covalente.
- Se l'elettronegatività tra due atomi differenti è maggiore di 2, gli atomi si legano in un composto ionico tramite il legame ionico. La differenza è talmente elevata da causare il trasferimento permanente di un elettrone da un atomo all'altro.
- Se l'elettronegatività tra due atomi differenti è inferiore di 2, gli atomi si legano in un molecola tramite il legame covalente. La differenza è bassa, non è sufficiente da causare il trasferimento permanente di un elettrone da un atomo all'altro. Quindi, gli elettroni del legame continuano a orbitare su entrambi gli atomi della molecola.
Nota. Nel caso di due atomi uguali la differenza di elettronegatività è zero, quindi il legame è covalente puro.
Alcuni libri scolastici italiani propongono anche la seguente classificazione:
- Se $ \Delta x < 0,4 $ è un legame covalente puro
- Se $ 0,4 < \Delta x \le 1,8 $ è un legame covalente polare
- Se $ \Delta x > 1,8 $ è un legame ionico
Tuttavia, si tratta di soglie puramente convenzionali, molto utili per la didattica. Nella pratica i confini sono molto più sfumati.
La differenza di elettronegatività non stabilisce dei confini rigidi tra legami ionici e covalenti, e numerosi casi limite non rientrano in questi intervalli.
In generale, si può solo affermare che una differenza molto grande suggerisce una forte tendenza al comportamento ionico, mentre una differenza piccola indica un legame covalente.
Nota. La differenza di elettronegatività non determina in modo assoluto la natura ionica o covalente del legame, perché il carattere ionico dipende anche da altri fattori fisici (es. energia di ionizzazione, affinità elettronica, stabilizzazione del reticolo, ambiente chimico).
E così via.
Domande degli utenti
- Domanda. La dichiarazione "in un periodo l'elettronegatività cresce con il numero atomico perché cresce la carica nucleare per elettrone ossia la forza di attrazione" è sbagliata? Non è vero il contrario, dato che gli elettroni delle orbite che si accavallano schermano l’attrazione dei protoni, superando l’effetto dell’aumento della carica nucleare?
Risposta. In realtà, lungo un periodo l’elettronegatività aumenta proprio perché la carica nucleare efficace cresce. Gli elettroni aggiunti procedendo da sinistra verso destra occupano lo stesso livello energetico e contribuiscono molto poco alla schermatura. L’aumento dei protoni nel nucleo non viene quindi compensato, e l’attrazione sugli elettroni di valenza diventa maggiore. L’effetto schermante che supera l’attrazione nucleare non si verifica nel periodo, ma scendendo lungo un gruppo, quando si aggiungono nuovi gusci elettronici. È un fenomeno diverso.
