Regola di Hund
Cosa dice la regola di Hund
Quando gli elettroni si trovano su orbitali di pari energia (orbitali degeneri) si dispongono ognuno su un orbitale diverso con spin parallelo agli altri.
Questa regola è anche detta principio della molteplicità.
E' alla base della configurazione elettronica degli atomi.
Cos'è lo spin? E' il numero quantico che indica il verso della rotazione (polarità) dell'elettrone su se stesso. Può assumere solo due valori: up o down.
Un esempio pratico
L'atomo di azoto ha numero atomico Z=7.
Pertanto, ha sette elettroni.
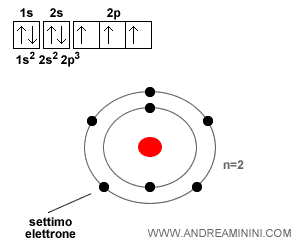
Nota. Nella rappresentazione del diagramma orbitale ogni quadratino è un orbitale atomico. Ogni freccia è un elettrone. Il verso della freccia è lo spin (up/down) dell'elettrone.
I primi due elettroni si dispongono sull'orbitale 1s.
Il terzo e quarto elettrone si dispongono sull'orbitale 2s.
Gli ultimi tre elettroni occupano ciascuno un orbitale del sottolivello p disponendosi tutti con lo spin verso l'alto (up).
E così via.
