Legame chimico
Cosa sono i legami chimici
Il legame chimico è la forza attrattiva che unisce due o più atomi uguali o diversi formando una molecola o un aggregato cristallino.
Gli atomi isolati tendono a combinarsi tra loro per stabilizzare la propria struttura a un livello energetico minimo.
$$ A \: + \: B \rightarrow AB \: + \: energia $$
Il sistema aggregato è più stabile di quello di partenza, perché una parte dell'energia iniziale viene ceduta all'esterno, detta energia di legame (o energia di dissociazione del legame).
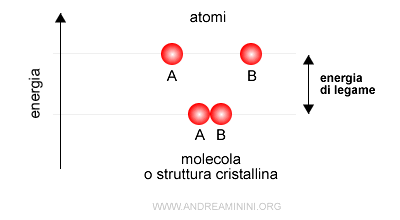
Pertanto, due o più atomi si legano tra loro soltanto se l'aggregato ha un contenuto energetico minore della somma dei singoli atomi isolati.
Questo però accade soltanto se sono soddisfatte alcune condizioni.
Nota. Qualsiasi processo in natura tende spontaneamente a raggiungere un valore di energia più basso. Ad esempio, i fiumi scorrono verso il mare.
Soltanto i gas nobili sono caratterizzati da una stabilità, dovuta alla saturazione degli orbitali esterni, tale da consentire loro di esistere in forma atomica semplice.
I gas nobili hanno un elevato livello di energia di ionizzazione.
Gli altri elementi chimici, invece, devono cedere, acquistare o mettere in comune gli elettroni di valenza con altri atomi per raggiungere uno stato elettronico esterno più stabile, simile a quello del gas nobile più vicino.
Questa regola è conosciuta come regola dell'ottetto.
Nota. Si chiama regola dell'ottetto perché la configurazione stabile dei gas nobili è composta da 8 elettroni di valenza (ottetto). Pertanto, tutti gli elementi chimici tendono a formare legami con altri atomi, a seconda della loro elettronegatività, per raggiungere uno stato elettronico esterno più stabile composto da otto elettroni.
L'energia di legame
L'energia di legame è l'energia necessaria per formare o rompere una mole di legami chimici tra gli atomi.
E' anche detta energia di dissociazione del legame.
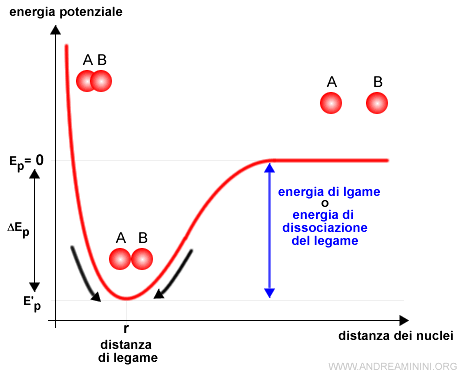
L'energia potenziale del legame è nulla quando gli atomi si trovano a distanza infinita.
Alla distanza di legame (r) le forze attrattive e repulsive sono in equilibrio.
Spiegazione. A destra della distanza di legame prevalgono le forze attrattive tra le particelle con cariche opposte che spingono gli atomi ad avvicinarsi. A sinistra della distanza di legame prevalgono, invece, le forze repulsive tra le particelle con la stessa carica che spingono gli atomi ad allontanarsi. Alla distanza di legame le forze attrattive e repulsive si equivalgono.
L'energia potenziale alla distanza di legame è negativa perché gli atomi legati perdono energia.
Questa differenza di energia potenziale ΔEp è detta energia di legame.
La distanza di legame
La distanza di legame è la distanza tra i nuclei atomici in cui l'energia potenziale degli atomi legati è minima, più bassa rispetto all'energia potenziale degli atomi non legati.
Alla distanza di legame il legame chimico tra gli atomi si stabilizza perché le forze repulsive e attrattive si compensano.
Il punto minimo della distanza di legame si raggiunge allo zero assoluto, quando tutti i movimenti termini si annullano e si considera soltanto l'energia potenziale.
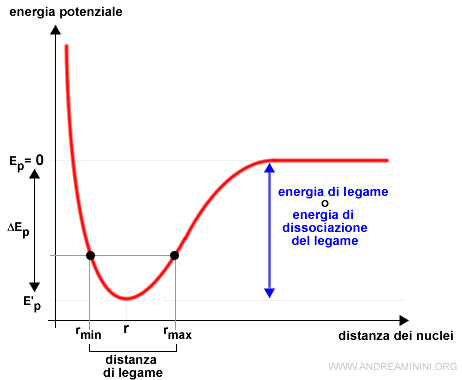
A temperature superiori, la distanza di legame non è esattamente r ma oscilla in un range di valori, perché l'energia potenziale è leggermente più alta.
Tipi di legami chimici
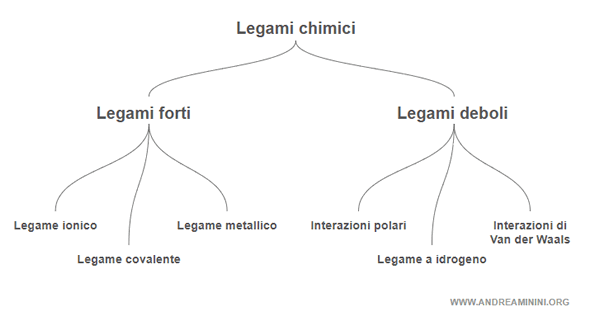
Esistono due grandi categorie di legami chimici
- Legami forti
Un legame forte si basa sull'interazione degli elettroni di valenza degli atomi. Sono anche detti legami intramolecolari.
- Legame ionico
Un elettrone si trasferisce da un atomo all'altro. Si forma tra un elemento molto elettronegativo e un elemento molto elettropositivo. - Legame covalente
Un elettrone orbita intorno a entrambi gli atomi. Si forma tra elementi con elettronegatività uguale o confrontabile. - Legame metallico
Gli elettroni formano una nube intorno agli ioni positivi. Si forma tra elementi molto poco elettronegativi.
- Legame ionico
- Legami deboli
Un legame debole si basa su altre forze attrattive di tipo elettrostatico tra le molecole oppure tra ioni e molecole. Per questa ragione sono anche detti legami intermolecolari.- Interazioni polari
Si basa sull'interazione dipolo/dipolo tra molecole polari. - Legame a idrogeno
Si basa sull'interazione polare tra le molecole tramite un atomo di idrogeno. - Forze o interazione di Van der Waals
Si basa sull'interazione tra le molecole apolari (non polari) tramite dipoli istantanei.
- Interazioni polari
E così via.
