La valenza
La valenza è la capacità di un atomo di combinarsi o di sostituire uno o più atomi di idrogeno.
In pratica, la valenza di un atomo è il numero di elettroni che l'atomo mette a disposizione per formare i legami chimici con gli altri atomi.
Quali elettroni?
Non tutti gli elettroni sono utili per formare i legami, soltanto quelli situati nel livello energetico più esterno dell'atomo.
- Se il livello energetico più esterno è completo, l'atomo non si lega con altri atomi. Ad esempio l'elio.
- Se il livello energetico più esterno è incompleto, i posti vuoti possono essere occupati dagli elettroni di altri atomi, formando così un legame tra gli atomi. Ad esempio, ossigeno e idrogeno.
Gli elettroni nel livello energetico più esterno dell'atomo sono detti elettroni di valenza. Sono al massimo otto.
In genere, gli elettroni di valenza si trovano sui sottolivelli di tipo s e p nei vari livelli energetici (n) più esterni della configurazione elettronica superficiale dell'atomo, ossia la disposizione degli elettroni sul livello energetico più esterno.
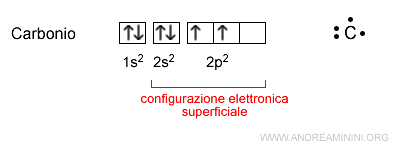
Se l'atomo di un elemento ha un solo elettrone di valenza (es. idrogeno) l'elemento è detto monovalente.
Se ha due elettroni di valenza è detto bivalente. Se ne ha tre è detto trivalente, ecc.
E se un elemento non si combina con l'idrogeno? Se un elemento chimico X non si lega con l'idrogeno, la valenza si misura usando un altro elemento monovalente che si lega a X. La scelta dell'idrogeno come riferimento è dovuta al fatto che ha valenza uguale a uno. Oltre all'idrogeno anche altri elementi chimici hanno una solo valenza, ossia sono monovalenti.
Un esempio pratico
Esempio 1 (idrogeno)
L'atomo di idrogeno ha numero atomico Z=1. Pertanto, ha un solo protone e un solo elettrone.
Nella configurazione elettronica di un atomo gli elettroni tendono a occupare sempre l'orbitale libero più basso, quello a minore energia.
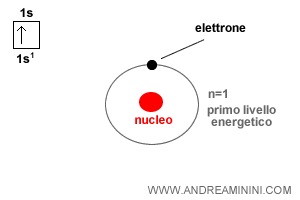
Nel caso dell'idrogeno è libero il primo orbitale 1s che può ospitare due elettroni.
L'orbitale 1s è il livello energetico più basso (n=1) ed è il primo a riempirsi.
Nota. In un orbitale gli elettroni devono avere lo spin (rotazione) opposto. Il motivo è legato alla polarità che non deve essere uguale. In genere lo spin si indica con il simbolo di una freccia verso l'alto o verso il basso. Si comincia con quella verso l'alto. Per approfondire l'argomento consiglio di dare un'occhiata alle regole di riempimento degli orbitali atomici.
L'orbitale 1s dell'atomo di idrogeno è però incompleto perché un posto è ancora libero.
Per completare l'orbitale più esterno l'atomo di idrogeno ha bisogno di un altro elettrone.
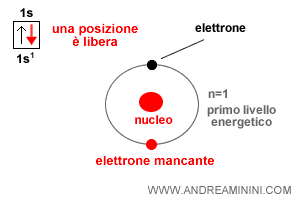
Quindi, l'atomo di idrogeno ha valenza 1.
Esempio 2 (ossigeno)
Ora prendo in considerazione un atomo di ossigeno (O) che ha numero atomico Z=8, quindi ha otto elettroni.
I primi due elettroni si collocano nel primo orbitale 1s.

Il terzo e quarto elettrone si collocano nel secondo orbitale 2s nel secondo livello energetico (n=2).
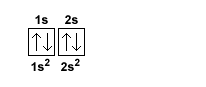
I restanti quattro elettroni si collocano nel terzo orbitale 2p nel secondo livello energetico (n=2).
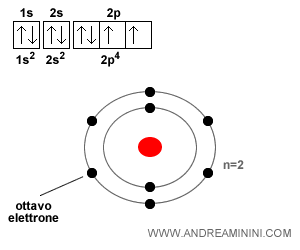
Nota. Gli orbitali 2s e 2p fanno entrambi parte del secondo livello energetico (n=2). Per questa ragione nella rappresentazione grafica gli elettroni 2s e 2p sono collocati nel secondo cerchio. La rappresentazione in alto a sinistra, invece, specifica quali posti sono ancora vuoti nei singoli orbitali. La regola del riempimento si applica al singolo orbitale e non al livello energetico.
Nel caso dell'atomo di ossigeno l'orbitale più esterno è il 2p ed è incompleto perché due posti sono ancora liberi.
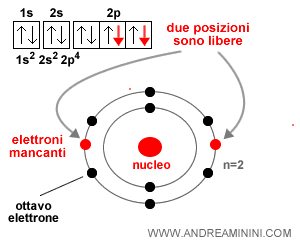
Nota. L'orbitale 2p ha sei posti disponibili. Quattro posti sono occupati dagli elettroni mentre altri due sono liberi.
Per completare il l'orbitale (livello energetico) più esterno l'atomo di ossigeno ha bisogno di altri due elettroni aggiuntivi.
Pertanto, l'atomo di ossigeno può formare due legami con due atomi di idrogeno.
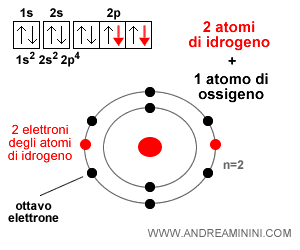
Quindi, l'ossigeno ha valenza 2.
Nota. Il doppio legame tra l'ossigeno con due atomi di idrogeno forma una molecola d'acqua. Ecco spiegato il motivo per cui la formula dell'acqua è H2O.
I simboli di Lewis
I simboli di Lewis sono usati per rappresentare gli elettroni di valenza, aggiungendo dei puntini intorno al simbolo dell'elemento chimico.
Ogni puntino indica un elettrone di valenza.
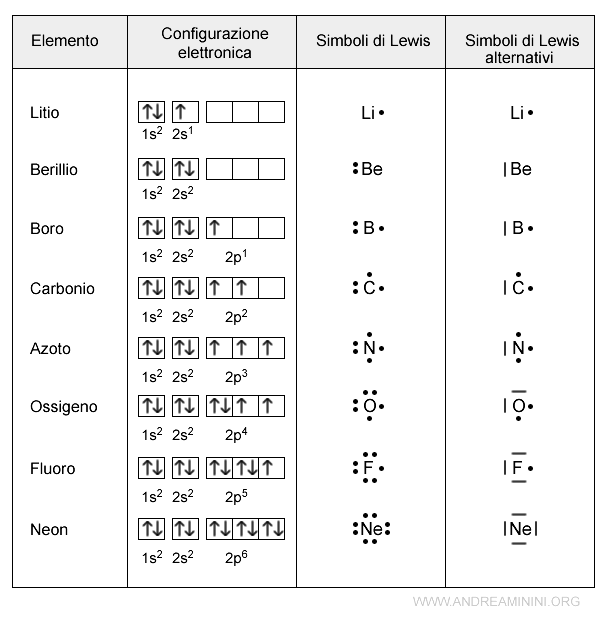
Il doppio puntino su un lato vuol dire che un orbitale è saturo.
Nota. In alcuni testi il doppio puntino è sostituito con una linea. Il significato è sempre lo stesso.
Il numero degli orbitali della configurazione superficiale varia da caso a caso.
In ogni caso gli elettroni di valenza non sono mai più di otto.
E così via.
