I solidi
Cosa sono i solidi
Lo stato solido è uno stato fisico in cui la materia ha volume e forma propria.
E' uno degli stati fisici fondamentali della materia insieme allo stato liquido e allo stato aeriforme.
I solidi sono anche caratterizzati da maggiore resistenza alla compressione rispetto ai liquidi e ai gas.
In ogni caso le caratteristiche dei solidi variano a seconda dei casi.
Nota. Il comportamento generale di un gas è facilmente prevedibile in un ampio intervallo di condizioni perché molte caratteristiche sono comuni. Nei solidi, invece, i comportamenti sono molto diversi. Ad esempio, la temperatura di fusione è variabile e spesso non è ben definita. Inoltre, molte proprietà (es. durezza, sfaldabilità, conducibilità elettrica, resistenza alla rottura, indice di rifrazione, ecc.) possono dipendere dalla direzione considerata (anisotropia).
Perché i solidi hanno volume e forma propria
Nello stato solido la materia è caratterizzata da un'elevata densità delle particelle (atomi, ioni o molecole).
L'interazione con le altre particelle, causata dalla vicinanza, mantiene le particelle in una posizione.
Grazie alla vicinanza si formano forti legami chimici tra le particelle (ionici, covalenti, metallici) o legami intermolecolari (legami di van der Waals, legami a idrogeno) .
La forza dei legami chimici impedisce alle particelle di muoversi. Possono soltanto oscillare intorno a una posizione con un moto vibrazionale.
Pertanto, in un solido le forze attrattive prevalgono sull'energia cinetica translazionale delle particelle.
Nota. Nei solidi l'energia cinetica delle particelle è solo vibrazionale, non è translazionale. A differenza della materia nello stato aeriforme e nello stato liquido, nello stato solido le particelle non sono libere di muoversi. Per questa ragione i solidi appartengono alla categoria dei condensati. L'immobilità e la vicinanza tra le particelle rendono la materia incomprimibile. Nei gas, invece, le particelle sono libere di muoversi in modo casuale perché l'interazione è minima o nulla. Per questa ragione i gas appartengono alla categoria dei fluidi.
Le particelle di un solido hanno soprattutto un'energia cinetica di tipo vibrazionale, ossia vibrano intorno a una posizione di equilibrio dotata di minima energia.
Le vibrazioni delle particelle sono influenzate da due fattori:
- la temperatura
- l'interazione con le altre particelle
Tipi di solidi
Esistono due tipologie di solidi
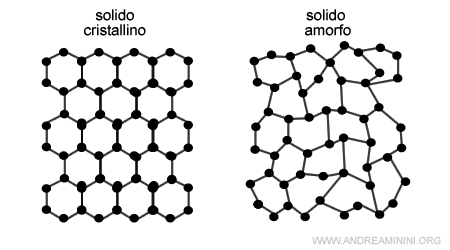
- I solidi cristallini
Nei solidi cristallini le particelle (atomi, ioni o molecole) si dispongono in una struttura geometrica ordinata e regolare detta reticolo. Ne esistono di diverse forme. Sono composti da cristalli singoli o da aggregati di piccoli cristalli. Hanno una temperatura di fusione netta. La maggior parte dei solidi a temperatura ordinaria esistenti in natura sono solidi cristallini. Ad esempio, sono solidi cristallini i metalli e i sali. - I solidi amorfi
Nei solidi amorfi le particelle si dispongono senza seguire un ordine particolare. Il disordine prevale sull'ordine. Non hanno una temperatura di fusione netta, bensì un ampio intervallo di fusione. I solidi amorfi sono classificati in base alla forza che tiene uniti i suoi costituenti chimici. I solidi amorfi rappresentano una minoranza di sostanze solide presenti in natura. Ad esempio, sono solidi amorfi i vetri, le gomme e le plastiche. I vetri sono i primi solidi amorfi ad essere stati scoperti. Per questa ragione i solidi amorfi erano anche detti solidi allo stato vetroso.
La fusione
La fusione è il passaggio di stato da solido a liquido.
Se somministro calore a un solido, aumenta l'energia cinetica delle particelle.
Quando l'energia cinetica è superiore alla forza attrattiva delle particelle, spezza i legami chimici e il solido diventa liquido.
La quantità di calore necessaria per avviare il processo di fusione di un solido è detta calore latente di fusione.
La temperatura di fusione (o punto di fusione) è la temperatura in cui si verifica il passaggio di stato da solido a liquido.
- Nei solidi cristallini la temperatura di fusione è fissa e ben definita entro un margine di variazione di 1-2°C, perché la disposizione delle particelle segue un ordine regolare e i legami chimici tra le particelle hanno la stessa energia.
- Nei solidi amorfi, invece, non c'è un punto di fusione netto ma un ampio intervallo di fusione.La temperatura in cui inizia il processo di fusione di un solido amorfo è detta temperatura di rammollimento.
Esempio. Il riscaldamento del vetro, delle gomme o delle plastiche (solidi amorfi) dapprima rammollisce il solido, poi lo trasforma gradualmente in un liquido a temperatura di fusione non ben definita.
La solidificazione
La solidificazione è il passaggio di stato da liquido a solido.
Durante il processo di solidificazione la materia rilascia una quantità di calore detta calore di solidificazione.
Il calore di solidificazione è uguale al calore latente di fusione perché la trasformazione di stato è opposta.
La sublimazione
La sublimazione è il passaggio di stato diretto da solido ad aeriforme, senza passare per lo stato liquido.
Alcuni solidi con elevata tensione di vapore si trasformano direttamente da solidi a gassosi.
Ad esempio, il diossido di carbonio (CO2) si trasforma in gas quando è esposto all'aria in condizioni ambientali di pressione (1 atm) e temperatura. E' usato come ghiaccio secco.
E così via.
