Legame a idrogeno
Il legame a idrogeno è un legame chimico debole di natura elettrostatica che si stabilisce tra un atomo di idrogeno legato covalentemente con un atomo di piccole dimensioni fortemente elettronegativo (es. ossigeno, fluoro, azoto) e un altro atomo dello stesso tipo di una molecola vicina.
Il legame a idrogeno si presenta nelle molecole polari come l'acqua (H2O), l'ammoniaca (NH3) e il fluoruro di idrogeno (HF).
Esistono due tipi di legame a idrogeno
- Legame a idrogeno intermolecolare
L'atomo di idrogeno forma un legame a idrogeno con un atomo di un'altra molecola. L'esempio più semplice è l'acqua. - Legame a idrogeno intramolecolare
L'atomo di idrogeno forma un legame a idrogeno con un altro atomo nella stessa molecola a cui appartiene.
Un esempio pratico
Le molecole d'acqua (H2O) sono composte da un atomo di ossigeno (O) e due atomi di idrogeno (H).
$$ 2H + O \rightarrow H_2O $$
Un atomo di ossigeno è più elettronegativo di un atomo di idrogeno. Quindi, gli elettroni del legame covalente H-O orbitano più a lungo intorno all'atomo di ossigeno rispetto all'atomo di idrogeno.
L'atomo di ossigeno acquisisce una temporanea polarità negativa (δ-), mentre gli atomi di idrogeno una temporanea polarità positiva (δ+).
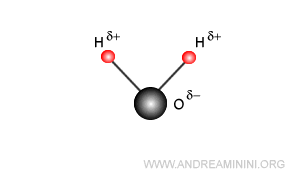
Pertanto, l'acqua è una molecola polare. Ha un polo negativo sull'atomo di ossigeno e un polo positivo sugli atomi di idrogeno.
Poiché l'atomo di idrogeno è molto piccolo, la carica positiva si distribuisce su una superficie e un volume ridotto. Quindi, negli atomi di idrogeno la densità della carica positiva (carica/volume) è molto forte, al punto da interagire con gli atomi di ossigeno delle molecole vicine.
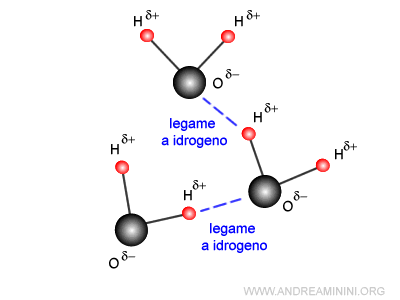
La forza elettrostatica tra l'atomo di idrogeno e l'atomo di ossigeno della molecola vicina è la causa del legame a idrogeno intermolecolare (blu tratteggiato) che tiene legate due molecole d'acqua.
Il legame a idrogeno è comunque un legame molto debole.
Nell'acqua allo stato liquido si rompe e si forma con facilità. Dura pochi istanti di tempo.
Nota. Il legame a idrogeno è molto più debole rispetto al legame covalente. L'energia di un legame a idrogeno è compresa tra 10 e 40 kJ/mol mentre il legame covalente O-H è circa 460 kJ/mol. Questo influisce anche sulla lunghezza dei legami. La lunghezza del legame a idrogeno è di circa 184 pm, mentre il legame covalente O-H è lungo 101 pm.
Tuttavia, pur essendo debole, il legame a idrogeno caratterizza le proprietà chimico-fisiche più importanti dell'acqua.
Esempio. Se non ci fosse il legame a idrogeno la molecola dell'acqua avrebbe un punto di fusione/solidificazione a -95°C e di ebollizione a -80°C. Quindi non esisterebbe allo stato liquido sulla Terra ma sarebbe prevalentemente allo stato gassoso (vapore acqueo). Grazie ai legami a idrogeno il punto di fusione/solidificazione è a 0°C mentre il punto di ebollizione è a 100°C.
La solidificazione
Quando la temperatura si abbassa intorno a 0°C il moto delle molecole si riduce.
Questo consente la formazione di più legami a idrogeno tra le molecole.
Inoltre, i legami diventano stabili e le molecole d'acqua si dispongono in una struttura cristallina esagonale per mantenere la stessa distanza l'una dall'altra.
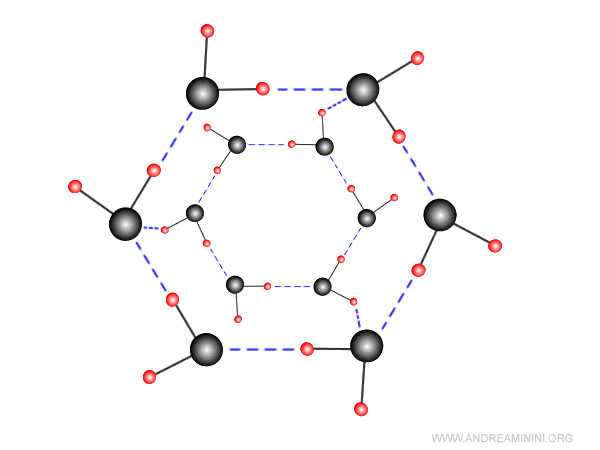
Ogni molecola d'acqua forma quattro legami a idrogeno permanenti con altrettante molecole d'acqua creando una struttura tetraedrica.
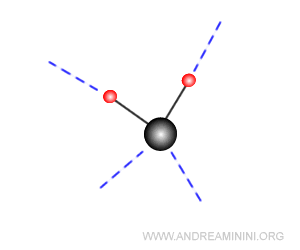
In questo modo l'acqua solidifica diventando ghiaccio.
Nota. Il maggior numero di legami a idrogeno aumenta anche la distanza tra le molecole d'acqua a causa della struttura cristallina. Per questa ragione il ghiaccio ha un volume maggiore dell'acqua allo stato solido. Quando l'acqua solidifica in ghiaccio espande il proprio volume. E' uno dei motivi per cui si rompono le tubature dell'acqua in inverno. Si tratta di un fenomeno peculiare e abbastanza raro in natura perché, normalmente, i liquidi diminuiscono di volume quando solidificano. Mentre l'acqua aumenta di volume. Inoltre, poiché il ghiaccio espande il proprio volume, a parità di massa il ghiaccio ha densità minore rispetto all'acqua liquida. Per questo motivo il ghiaccio galleggia sull'acqua.
La fusione
L'incremento della temperatura aumenta il moto delle molecole d'acqua, ostacolando la formazione dei legami a idrogeno.
La rottura dei legami a idrogeno nel ghiaccio causa il passaggio dell'acqua dallo stato solido allo stato liquido (fusione).
Fino a 4°C l'acqua riduce il proprio volume rispetto al ghiaccio.
A temperature superiori il volume dell'acqua torna di nuovo a crescere per effetto dell'agitazione termica.
L'evaporazione
In assenza completa di legami a idrogeno la molecola d'acqua passa allo stato gassoso ( vapore acqueo ) tramite il processo di evaporazione.
E così via.
