Legame ionico
Cos'è il legame ionico
Il legame ionico è un legame chimico di natura elettrostatica in cui uno o più elettroni si trasferiscono permanentemente da un atomo all'altro.
Si forma tra un elemento molto elettronegativo e un elemento molto elettropositivo.
E' detto "ionico" perché gli atomi si trasformano in ioni positivi e negativi.
La forza di attrazione elettrostatica tra gli ioni di carica opposta lega gli atomi tra loro.
Il legame ionico è molto più forte del legame covalente perché gli elettroni si spostano permanentemente da un atomo all'altro.
Nota. Il legame ionico può avvenire anche tra gruppi di atomi e non solo tra due atomi.
Come nasce il legame ionico
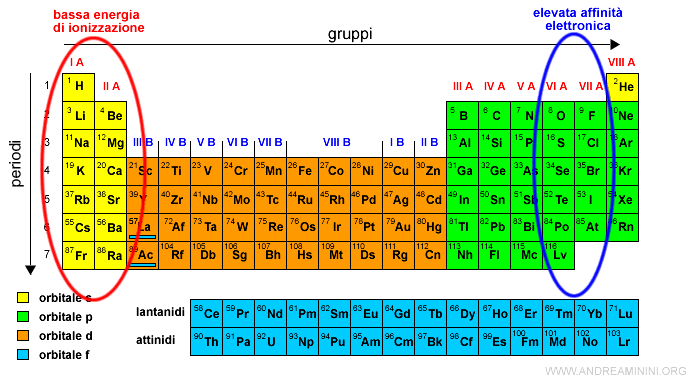
Il legame ionico si verifica quando due atomi hanno un'elevata differenza di elettronegatività.
In particolar modo si formano tra gli elementi che hanno una bassa energia di ionizzazione ( es. gruppi I A, II A ) e quelli con un'alta affinità elettronica ( es. gruppi VI A, VII A ).
I primi hanno un'elevata propensione a cedere elettrone mentre i secondi ad acquisirli.
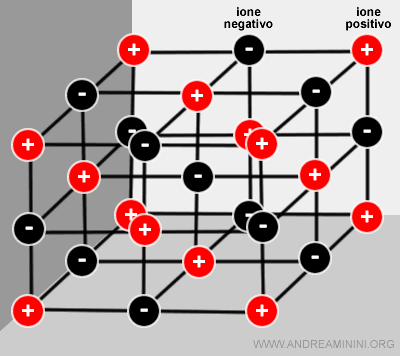
Il legame ionico è tipico nei sali e nei composti che formano cristalli.
Nota. Il legame ionico è più forte del legame covalente in quanto si stabilisce tra un insieme di ioni e non tra due atomi neutri. Per questa ragione le sostanze ottenute per legame ionico (es. sali) hanno un punto di fusione molto alto.
I composti ionici
Gli ioni positivi e negativi si legano tra loro formando un composto ionico solido o liquido.
Allo stato solido gli atomi si dispongono in modo geometrico regolare per eguagliare le forze di attrazione e repulsione reciproche degli ioni..
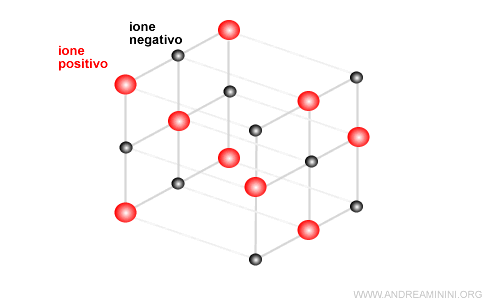
Questa struttura è detta reticolo cristallino ed è alla base dei solidi ionici ( o cristalli ionici ).
Esistono reticoli di diverse forme geometriche (cubiche, esagonali, ecc.) a seconda degli elementi chimici che li compongono.
Nota. In un solido ionico non ci sono molecole discrete perché il cristallo è composto soltanto da ioni positivi e negativi. Il rapporto tra il numero di ioni positivi e negativi nel solido ionico è detto peso formula che viene usato al posto del peso molecolare. Al posto della molecola si considera l'unità di formula.
Un esempio pratico
Un esempio di legame ionico si ha nel cloruro di sodio NaCl.
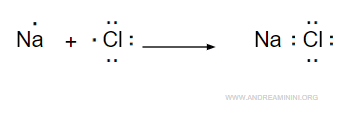
L'atomo di sodio (Na) cede permanentemente un elettrone trasformandosi in uno ione positivo (Na+) con una configurazione elettronica superficiale uguale al neon.
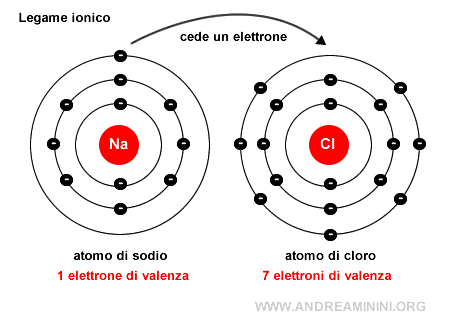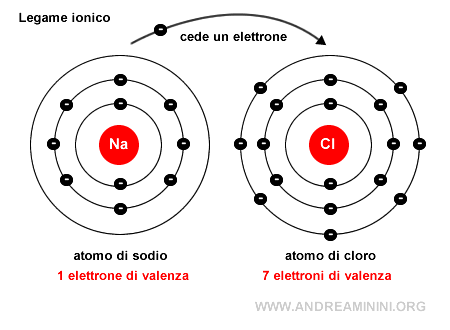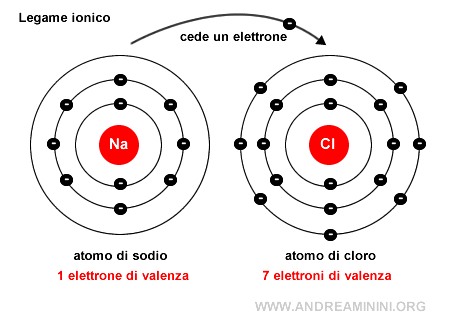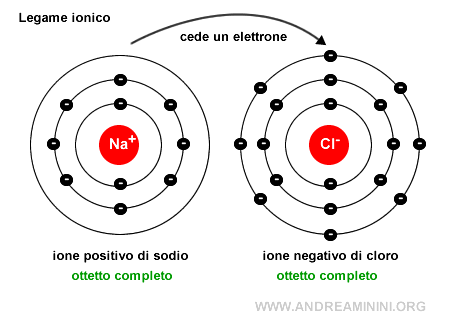
L'atomo di cloro (Cl) acquista permanentemente un elettrone trasformandosi in uno ione negativo (CL-) con una configurazione elettronica superficiale uguale all'argo.
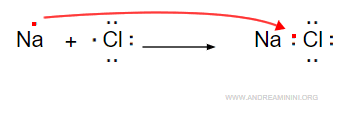
Entrambi gli atomi raggiungono una maggiore stabilità perché le configurazioni elettroniche superficiali sono identiche ai rispettivi gas nobili più vicini (neon e argo).
Nota. Il sodio (Na) ha un elettrone di valenza (3s1). Quando perde un elettrone diventa uno ione positivo (Na+) e la sua configurazione elettronica è uguale a quella del neon (Ne)
2s1 2s2 2p6 3s1(Na) - e- = 2s1 2s2 2p6 (Na+) = neon (Ne)
Il cloro (Cl) ha sette elettroni di valenza (3s2 3p5). Quando acquista un elettrone diventa uno ione negativo (Cl-) con otto elettroni di valenza (3s2 3p5+1) e la sua configurazione elettronica diventa uguale a quella dell'argo (Ar)
2s1 2s2 2p6 3s2 3p5 (Cl) + e- = 2s1 2s2 2p6 3s2 3p6 (Cl-) = argo (Ar)
La differenza elettrostatica tra sodio (Na+) e cloro (Cl-) genera una forza attrattiva che determina il legame chimico dei due atomi.
Senza il legame ionico l'atomo di sodio e di cloro non potrebbero formare un aggregato.
- Il sodio ha un'energia di ionizzazione di 494 kJ/mol. E' l'energia necessaria per togliere un elettrone dall'atomo di sodio.
- Il cloro ha un'affinità elettronica di -349 kJ/mol. E' l'energia liberata dall'atomo di cloro quando acquista un elettrone.
Pertanto, il trasferimento dell'elettrone dal sodio al cloro richiede un energia netta pari a
$$ 494 \: kJ/mol -349 \: kJ/mol= 145 \: kJ/mol $$
Questo legame non potrebbe mai avvenire in natura perché l'aggregato ha un livello di energia più alto (+145 kJ/mol).
Nota. In natura tutto si sposta verso il livello energetico più basso possibile. Ad esempio, una mela cade dall'albero al suolo, i fiumi scorrono verso il mare, ecc.
Tuttavia, se considero anche l'energia potenziale elettrostatica tra i due ioni
$$ E_p = -582 \: kJ/mol $$
Nota. L'energia potenziale tra due particelle di carica opposta è pari a $$ E_p = \frac{q_1 \cdot q_2}{4πε_0d} $$ Dove ε0=8,85·10-12C2*m-1·J-1 è una costante mentre d è la distanza tra i nuclei dei due atomi ed è pari a d=238·10-19 m. Sapendo che la carica di elettrone è q=1.6·10-19 C si ottiene $$ E_p = \frac{(1,6 \cdot 10^{19} C) \cdot (-1,6 \cdot 10^{19} C)}{4 \cdot 3,14 \cdot (8,85 \cdot 10^{-12} C^2 \cdot m^{-1} \cdot J^{-1}) \cdot (238 \cdot 10^{-12})} = -9,67 \cdot 10^{-19} J $$ Poi si moltiplica per il numero di Avogadro per ottenere l'energia potenziale riferita a una mole. $$ E_p = 9,67 \cdot 10^{-19} J \cdot 6,02 \cdot 10^{23} mol^{-1} = -582 \: kJ \: mol^{-1} $$
il bilancio cambia radicalmente.
$$ 494 \: kJ/mol -349 \: kJ/mol - 582 \: kJ/mol = -437 \: kJ/mol $$
Considerando la forza di attrazione elettrostatica l'aggregato NaCl giunge a un livello energetico più basso (-437 kJ/mol).
Per questa ragione si forma il di cloruro di sodio.
Il cloruro di sodio non è una molecola bensì un aggregato di ioni positivi e negativi incastonati in una struttura reticolare. Qual è la differenza? Una molecola è un'unità isolabile dagli altri. Il cloruro di sodio è invece un reticolo cristallino di ioni di varie dimensioni.
Questo calcolo è fatto sulla reazione che produce cloruro di sodio a partire da atomi di sodio gassoso e atomi di cloro.
Il calcolo sulla reazione chimica usata per produrre il cloruro di sodio allo stato solido da sodio solido e cloro molecolare è diverso e più complesso. E' indicato nell'esempio sul bilancio di energia.
Il bilancio di energia
Per calcolare il bilancio di energia del legame ionico devo considerare 5 fasi
- L'energia di sublimazione (ΔE1) per passare un elemento chimico dallo stato solido a gassoso
- L'energia di dissociazione (ΔE2) richiesta per rompere il legame ionico
- L'energia di ionizzazione (ΔE3) per togliere un elettrone da un atomo
- L'affinità elettronica (ΔE4) ossia l'energia rilasciata quando l'altro atomo acquista l'elettrone
- L'energia reticolare (Er) dovuta alla formazione di un reticolo cristallino tra gli atomi legati e gli altri atomi legati che contribuisce a rafforzare il legame.
Quindi, l'energia potenziale è determinata dalla somma di variazioni
$$ E_p = ΔE_1 +ΔE_2 + ΔE_3 + ΔE_4 + E_r $$
Un esempio pratico
Seguo i passaggi per calcolare l'energia potenziale di una mole di cloruro di sodio (NaCl) solido a partire da un sodio solido e di cloro molecolare gassoso.
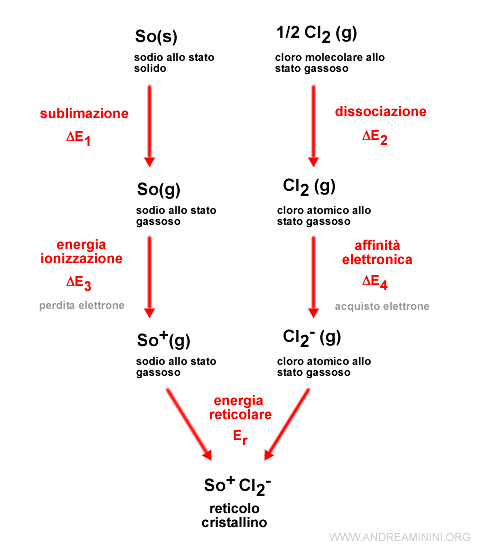
L'energia di sublimazione (ΔE1) è l'energia necessaria per trasformare il sodio da solido a gassoso
$$ Na(s) \rightarrow Na(g) $$
$$ ΔE_1 = +110 kJ/mol $$
L'energia di dissociazione (ΔE2) è l'energia necessaria per rompere il legame nelle molecole di cloro Cl2 e formare atomi di cloro
$$ \frac{1}{2} Cl_2(g) \rightarrow Cl(g) $$
$$ ΔE_2 = +120 kJ/mol $$
L'energia di ionizzazione (ΔE3) per togliere un elettrone dagli atomi di sodio e trasformarli in ioni positivi
$$ Na(g) \rightarrow Na^+(g) + e^- $$
$$ ΔE_3 = +494 kJ/mol $$
L'affinità elettronica (ΔE4) ossia l'energia rilasciata dagli atomi di cloro quando acquistano un elettrone e si trasformano in ioni negativi.
$$ Cl(g) + e^- \rightarrow Cl^-(g) $$
$$ ΔE_4 = -349 kJ/mol $$
L'energia reticolare (Er) che si ottiene da un reticolo cristallino
$$ Na^+(g) + Cl^-(g) \rightarrow N_aCl(s) $$
$$ E_r = -790 kJ/mol $$
La somma algebrica delle energie è pari all'energia potenziale di una mole di cloruro di sodio (NaCl)
$$ E_p = ΔE_1 + ΔE_2 + ΔE_3 + ΔE_4 + E_r $$
$$ E_p = 110 + 120 + 494 - 349 -790 kJ/mol $$
$$ E_p = -415 kJ/mol $$
Quindi, dalla reazione chimica tra sodio solido e cloro molecolare gassoso sono rilasciati 415 kJ/mol.
Nota. Senza l'energia reticolare il bilancio sarebbe stato positivo e non si sarebbe formato il prodotto. Pertanto, a tenere unito i cristalli di cloruro di sodio allo stato solido è essenzialmente l'energia di reticolo che viene generata dal composto ionico stesso.
La rappresentazione dei composti ionici
I composti ionici non possono essere rappresentati dalle strutture di Lewis perché il legame ha natura elettrostatica tra gli ioni di segno opposto e non si basa sulla condivisione degli elettroni.
Per indicare un composto ionico è sufficiente scrivere gli elementi, indicando quali sono i cationi e gli anioni.
$$ Na^+ \: Cl^- $$
Il catione o l'anione può anche essere una struttura poliatomica.
In questo caso, si indica la struttura tra parentesi quadre indicando anche l'eventuale legame degli atomi con i simboli di Lewis.
$$ 2H^+ \: [CO_3]^{2-} $$
Bisogna però fare attenzione, la struttura poliatomica è uno ione poliatomico. Quindi, gli elettroni di valenza sono determinati dalla carica dello ione poliatomico.
Ad esempio, la struttura CO32- ha due elettroni in più.
E così via.
