I liquidi
Lo stato liquido è uno stato di aggregazione della materia. Allo stato liquido la materia ha un volume ma non una forma propria. Assumono la forma del recipiente che li contiene.
I liquidi hanno caratteristiche intermedie tra i gas e i solidi.
Hanno un livello di entropia (disordine) superiore ai solidi e inferiore ai gas.
Anche le forze intermolecolari sono intermedie tra quelle di un solido e quelle di una sostanza aeriforme.
Nota. Per questa ragione, a parità di temperatura, i liquidi hanno maggiore densità di un gas. Le forze intermolecolari di un liquido sono maggiori rispetto a una sostanza aeriforme. Tuttavia, le forze intermolecolari non sono sufficienti a mantenere le particelle ferme in una posizione fissa come nei solidi. In un solido le forze intermolecolari sono più forti.
Nei liquidi il volume libero, non occupato dalle particelle, è circa il 3%. E' più basso dei gas e più alto dei solidi.
La spiegazione
Le particelle di un liquido si muovono liberamente in modo disordinato come quelle di un gas ma con una minore energia cinetica.
L'energia cinetica dei liquidi non è sufficiente a vincere la forza attrattiva tra le molecole.
Pertanto, in un liquido si formano solo legami temporanei intermolecolari (es. forze di van der Waals, interazioni polari, legami a idrogeno).
Ne consegue che la densità di liquido è superiore rispetto a un gas a parità di condizioni ambientali, perché in uno stessa unità di spazio sono presenti un maggior numero di particelle.
A causa della maggiore densità, le particelle di un liquido sono più soggette agli urti con le altre particelle rispetto ai gas.
Gli urti rallentano il moto delle particelle del liquido (energia cinetica) e aumentano la formazione di legami intermolecolari.
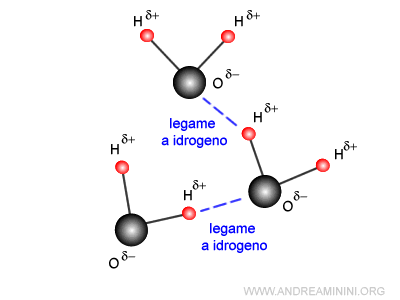
I legami intermolecolari si formano e si rompono continuamente in breve istanti di tempo.
Per questa ragione i liquidi tendono a mescolarsi.
Nota. Lo stesso accade nei gas. In un gas, però, il mescolamento avviene più rapidamente perché sono le particelle più veloci e meno soggette agli urti con altre particelle.
Le caratteristiche dei liquidi
Ecco alcune caratteristiche di un liquido
- Un liquido ha un volume ma non una forma
Il moto delle particelle del liquido è inferiore rispetto ai gas e superiore rispetto ai solidi. L'energia cinetica delle particelle non è sufficiente a impedire la formazione di legami intermolecolari anche se temporanei e variabili. - Un liquido è poco comprimibile
Spesso si afferma che un liquido è incomprimibile. Si tratta di una semplificazione. Nella realtà anche i liquidi sono comprimibili anche se in modo molto limitato e ad alti livelli di pressione. La comprimibilità dei liquidi è intermedia tra quella dei gas e quella dei solidi. - La viscosità
La viscosità è l'attrito interno tra le molecole del liquido. Si tratta di una misura della resistenza del fluido allo scorrimento. E' dovuta alle interazioni tra le molecole che ne rallentano il moto. Quanto più un liquido è viscoso, tanto meno le sue particelle sono veloci e libere di muoversi nello spazio. La minore velocità aumenta la formazione dei legami intermolecolari.Nota. La viscosità del liquido varia con la temperatura. E' più bassa ad alte temperature perché il calore aumenta l'energia cinetica delle particelle. E viceversa.
- La tensione superficiale
La tensione superficiale è la forza di coesione delle particelle sulla superficie del liquido. E' dovuta alla mancanza di legami su un lato. La superficie di un liquido ha caratteristiche diverse rispetto al resto della massa, perché sulla superficie le forze intermolecolari non sono bilanciate. Quindi, si verificano fenomeni diversi come la tensione superficiale. Le particelle interne del liquido formano legami intermolecolari in ogni direzione. Le molecole sulla superficie, invece, formano dei legami solo ai lati e verso l'interno del liquido. Pertanto, le molecole sono "trattenute" nel liquido da una forza interna e si staccano soltanto quando viene vinta.
Nota. A causa della tensione superficiale la superficie di un liquido è curva. Ad esempio, per questa ragione una goccia d'acqua ha una forma sferica. Senza la tensione superficiale le molecole del liquido si diffonderebbero sul piano in un piccolissimo strato a livello molecolare.
La tensione superficiale varia con la temperatura. Si riduce con l'aumentare della temperatura perché il calore aumenta l'energia cinetica delle particelle. E viceversa.

- La tensione vapore
E' la tendenza delle molecole sulla superficie del liquido all'evaporazione, ossia al passaggio dallo stato liquido allo stato aeriforme (fase vapore) in un sistema chiuso.
Il diagramma di stato dei liquidi
Il diagramma di stato (o diagramma di fase) mostra le transizioni di fase della materia.
Ogni sostanza è caratterizzata da un proprio diagramma di fase.
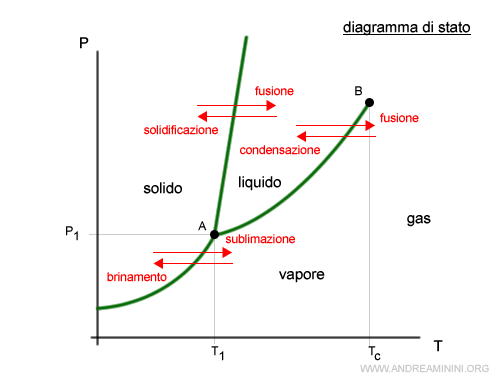
Nota. Per fase si intende la parte di una sostanza caratterizzata dalla stessa composizione chimica nello stesso stato fisico, ben distinta dalle altre parti della sostanza.
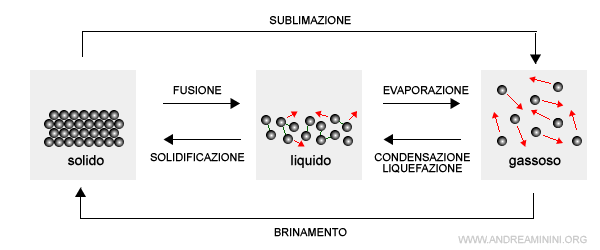
I liquidi hanno transizione di fase verso i solidi e il vapore.
- Il passaggio di stato da liquido a solido è detto solidificazione, mentre quello inverso da solido a liquido è detto fusione.
- Il passaggio di stato da liquido a vapore è detto evaporazione, mentre quello da vapore a liquido è detto condensazione.
E così via.
