Forze di van der Waals
Le forze di van der Waals sono interazioni intermolecolari di natura elettrostatica tra molecole apolari generate dalla formazione di dipoli istantanei.
Le forze di van der Waals formano un legame chimico con una energia di legame di pochi decimi di kJ/mol. Molto debole.
L'intensità del legame si riduce rapidamente con l'aumentare della distanza tra le molecole.
Cos'è un dipolo istantaneo? Un dipolo istantaneo è una molecola non polare che in alcuni istanti acquisisce una polarità, a causa del moto caotico degli elettroni, diventando un dipolo.
L'energia di legame del dipolo istantaneo è comunque molto lieve, circa 1/10 di kJ/mol. Per fare un confronto basti pensare che il legame covalente o il legame ionico hanno un'energia di legame di diverse centinaia di kJ/mol.
Pur essendo molto deboli, le forze di van der Waals sono determinanti nel definire lo stato liquido, solido o gassoso della materia.
La spiegazione
Una molecola non polare può trasformarsi temporaneamente in un dipolo.
In alcuni istanti gli elettroni possono distribuirsi in modo asimmetrico nella molecola polare, dando origine a un polo di carica positiva e un polo di carica negativa.
Esempio. Una molecola di idrogeno H-H è composta da due atomi di idrogeno legati in modo covalente da una coppia di elettroni. Si tratta di una molecola non polare. Tuttavia, in alcuni istanti i due elettroni possono orbitare intorno allo stesso atomo che assume una carica negativa mentre l'altro atomo, privo di elettroni, assume una carica positiva. In questi istanti la molecola apolare si trasforma in un dipolo istantaneo con un polo negativo e un polo positivo. L'istante dopo il dipolo svanisce e la molecola ritorna apolare.
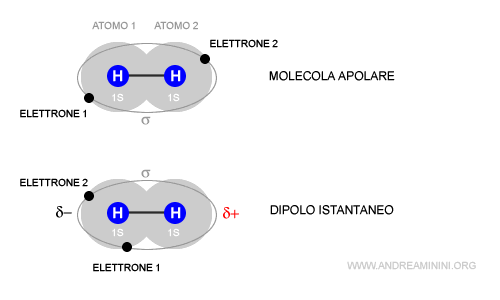
Il dipolo dura un solo istante e per questa ragione è detto dipolo istantaneo.
Un istante dopo il dipolo istantaneo cessa di esistere e la molecola torna a essere apolare.
Pur essendo breve e debole, il dipolo istantaneo genera comunque un campo elettrico che influenza per induzione elettrostatiche le molecole vicine.
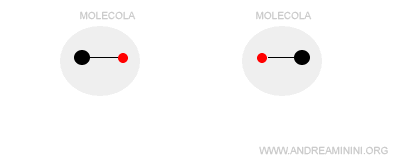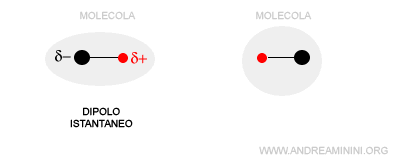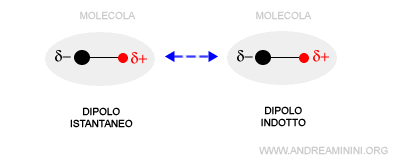
Gli elettroni delle molecole vicine (polari o apolari) sono attratti dal polo positivo o respinti dal polo negativo del dipolo istantaneo.
A loro volta, le molecole vicine diventano temporaneamente dei dipoli, detti dipoli indotti.
Nota. Sono detti dipoli indotti perché hanno origine dall'influenza di un dipolo istantaneo di un'altra molecola.
Le nuvole elettroniche dei dipoli indotti modificano temporaneamente la propria forma.
Quando il dipolo istantaneo torna ad essere una molecola apolare, anche i dipoli indotti tornano alla loro distribuzione naturale degli elettroni.
La polarizzabilità
La polarizzabilità misura la capacità di una molecola di diventare un dipolo indotto.
- Quanti più elettroni ha una molecola, tanto più la molecola ha una polarità più alta.
- Quanto più alto è il peso molecolare della molecola, tanto più la sua polarità è alta.
E così via.
