Tavola periodica degli elementi chimici
Cos'è la tavola periodica
La tavola periodica (o sistema periodico) è uno schema di classificazione degli elementi chimici seguendo l'ordine crescente del numero atomico.
E' detta periodica perché alcune proprietà degli elementi chimici si ripetono dopo intervalli regolari.
A cosa serve?
La posizione degli elementi chimici nella tavola periodica permette di risalire facilmente alla natura, alle caratteristiche (dimensioni, energia di ionizzazione, affinità elettronica, elettronegatività) e al comportamento chimico degli atomi.
Come funziona la tavola periodica
La tavola periodica è suddivisa in righe e colonne.
Gli elementi sono suddivisi in
- Gruppi
Sono le colonne della tavola periodica. Indicano il numero di elettroni di valenza nell'ultimo orbitale. A loro volta i gruppi sono suddivisi in due categorie:- Gruppi A
Appartengono a questa categoria 8 gruppi. Sono detti elementi rappresentativi o elementi tipici. - Gruppi B
Appartengono a questa categoria 8 gruppi. Sono detti elementi di transizione.
- Gruppi A
- Periodi
Sono le righe della tavola periodica. Ogni periodo è un numero intero che indica il livello energetico (numero quantico principale) degli elementi chimici disposti sulla riga. La riga più in alto è il periodo 1. Il periodo aumenta spostandosi verso il basso.
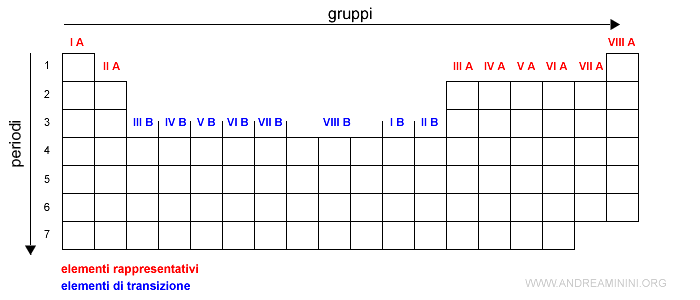
Gli elementi chimici sono ordinati per numero atomico.
Nota. Mi sono fermato al numero atomico Z=56 perché con il successivo inizia il sottolivello f che comprende 14 elettroni. La tavola andrebbe allungata ulteriormente rendendola però poco pratica. Per mantenere la compattezza della tavola si è scelto di aggiungere dei rimandi ad altre righe dette serie dei lantanidi e serie degli attinidi. Li approfondirò in seguito.
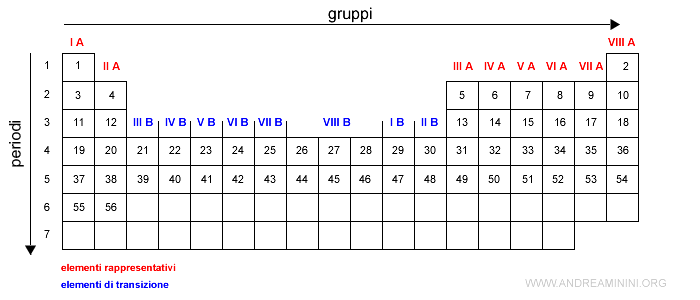
Ogni elemento chimico ha un solo numero atomico.
Quindi, in ogni casella posso scrivere il simbolo dell'elemento chimico corrispondente al numero atomico.
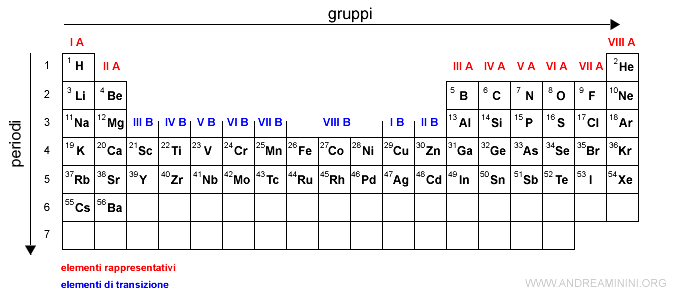
Ogni posizione nella tavola periodica fornisce un'informazione sulla struttura elettronica dell'elemento chimico.
Il numero atomico è il numero degli elettroni in un atomo neutro.
Gli elettroni occupano prima gli orbitali atomici a minore energia, tra quelli disponibili, e poi gli altri.
Nota. Ad esempio l'idrogeno ha un solo elettrone che occupa la prima posizione nell'orbitale 1s. L'elio ha due elettroni che occupano le due posizioni nell'orbitale 1s. Il litio ha tre elettroni che occupano le due posizioni di 1s e una posizione dell'orbitale 2s. E via dicendo.
La sequenza di riempimento degli elettroni è 1s, 2s, 2p, 3s, 3p, 4s, ecc.
Nella seguente tabella la sequenza procede dal basso verso l'alto.
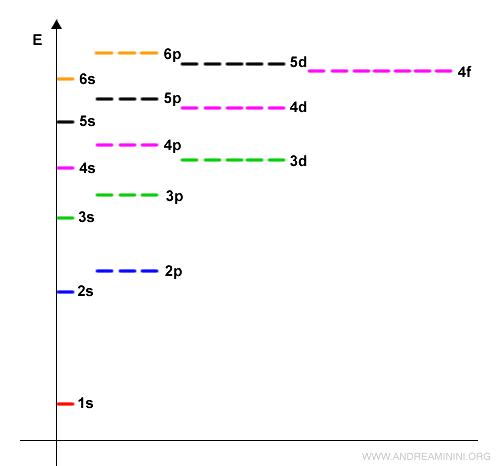
Le prime due colonne della tavola periodica, i gruppi I A e II A, indicano gli elementi con gli elettroni di valenza nell'orbitale di tipo s nei vari livelli energetici (1s, 2s, 3s, 4s, ecc).
Fa eccezione soltanto l'elio che viene spostato all'ultima colonna a destra perché ha le stesse proprietà dei gas nobili.
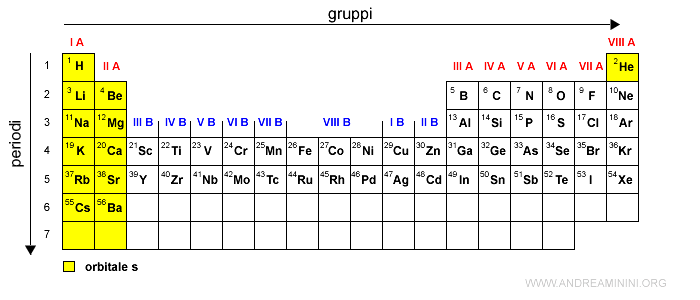
Cosa sono gli elettroni di valenza? Sono gli elettroni che occupano l'orbitale più esterno di un atomo. Man mano che aumenta il numero atomico (Z) dell'atomo, gli elettroni tendono a spostarsi sull'orbitale appena più esterno, quello che richiede minore energia tra tutti gli orbitali ancora vuoti. Ad esempio, il litio (Lt) ha numero atomico Z=3. Pertanto, ha tre elettroni. I primi due elettroni si dispongono sull'orbitale 1s al livello energetico n=1 (numero quantico principale) mentre il terzo elettrone si dispone sull'orbitale 2s al livello energetico n=2. Quest'ultimo è un elettrone di valenza.
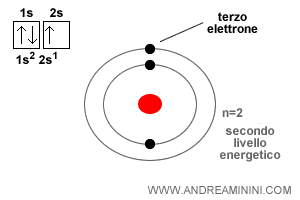
Tutti gli elementi nella colonna del Litio hanno un solo elettrone di valenza negli orbitali di tipo s. A cosa serve saperlo? La struttura elettronica degli elementi è molto importante perché il comportamento di un elemento chimico è determinato dal numero di elettroni presenti nel livello energetico più esterno (elettroni di valenza).
Le ultime sei colonne della tavola periodica, i gruppi dal III A al VIII A, indicano gli elementi con gli elettroni di valenza nell'orbitale di tipo p nei vari livelli energetici (2p, 3p, 4p, 5p, ecc).
Ogni orbitale di tipo p può ospitare al massimo 6 elettroni.
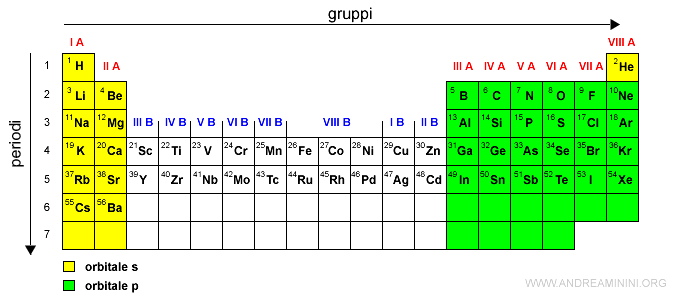
Esempio. L'ossigeno (O) ha numero atomico Z=8, la sua configurazione elettronica è 1s2 2s2 2p4. I primi due elettroni saturano l'orbitale 1s, il terzo e il quarto saturano l'orbitale 2s, i restanti 4 elettroni occupano i posti degli orbitali nel sottolivello 2p senza saturarlo perché il sottolivello 2p ha sei posti. Pertanto, l'ossigeno ha 4 elettroni di valenza nell'orbitale 2p.
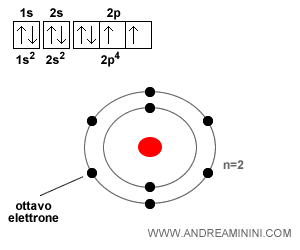
Tutti gli altri elementi nella stessa colonna dell'ossigeno (gruppo VI A) hanno 4 elettroni di valenza negli orbitali di tipo p su diversi livelli energetici. Ad esempio, lo zolfo (S) ha numero atomizo Z=16 e una configurazione elettronica pari a 1s2 2s2 2p6 3s2 3p4 e quattro elettroni di valenza nell'orbitale 3p. La struttura elettronica dell'ossigeno e del silicio è molto simile.
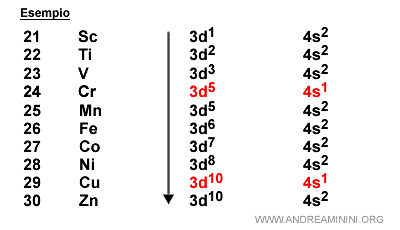
Lo scandio (Sc) ha numero atomico Z=21. E' il primo elemento nella prima riga del gruppo B.
La struttura elettronica dello scambio è 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Attenzione. Una volta saturo il sottolivello 4s, il sottolivello libero con minore energia è il 3d (non è il 4p).
Quindi, lo scandio ha un elettrone nel sottolivello 3d che può ospitare al massimo 10 elettroni.
Ogni riga centrale della tavola periodica del gruppo B ha 10 caselle e identifica gli elementi che hanno elettroni di valenza nel sottogruppo d.

Questi elementi sono detti elementi di transizione perché si riempiono gli orbitali dei sottolivelli più interni rispetto agli orbitali di valenza.
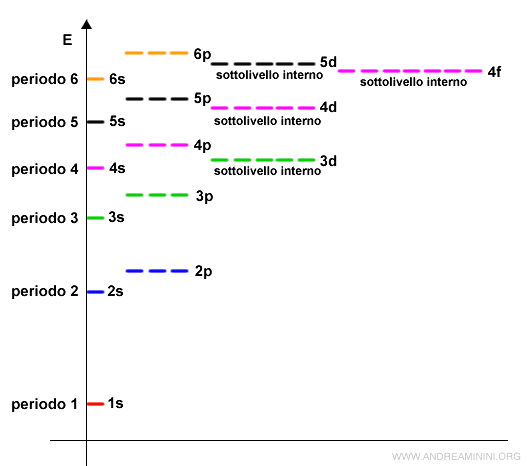
Esempio. La configurazione elettronica dello scandio (Sc) è 1s2 2s2 2p6 3s2 3p6 4s2 3d1. L'ultimo elettrone si colloca sul sottolivello 3d. Quest'ultimo (3d) è un sottolivello interno rispetto al livello energetico n=4 (periodo quattro). L'ultimo elettrone dello scandio si colloca negli orbitali 3d, ossia su un sottolivello interno, perché sono a minore energia rispetto agli orbitali di valenza (4p).
Negli elementi di transizioni si trovano i sottolivelli interni di tipo d e f.
Tuttavia, mentre i sottolivelli di tipo d ospitano 10 elettroni al massimo, quelli di tipo f ne ospitano 14.
Piuttosto che allungare la tavola periodica di altri 14 elementi di transizione, si è scelto di collocare i sottolivelli interni di tipo d sotto la tavola periodica.
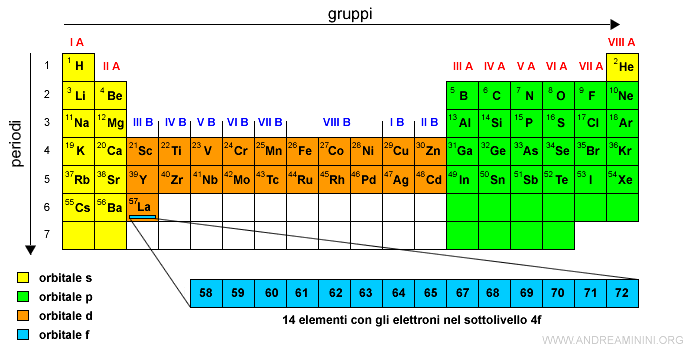
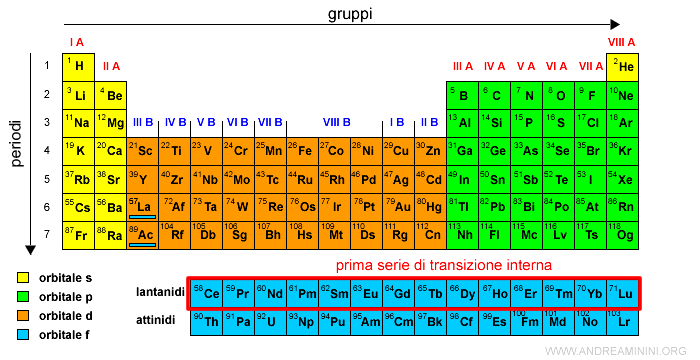
Il primo elemento di tipo f è il Cerio (Ce) con numero atomico Z=58.
La serie dei 14 elementi che si collocano nel sottolivello interno 4f si scrive in basso.
Questa serie è detta dei lantanidi (o terre rare), perché segue il Lantanio (La) che ha numero atomico Z=57 e si trova sull'orbitale 5d.
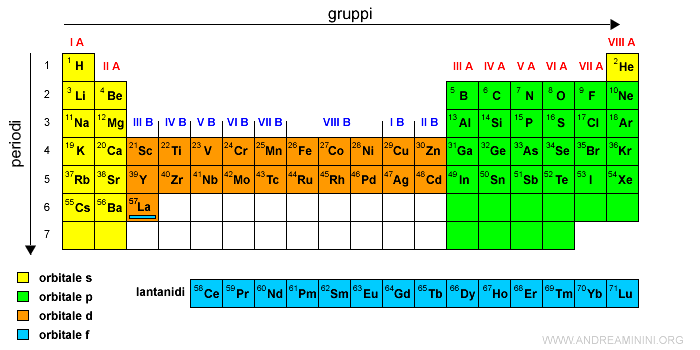
Una volta completato l'orbitale 4f con i lantanidi, gli elementi successivi spostano gli ultimi elettroni nei sottolivelli 5d, 6p, 7s.
Il primo elemento seguente è l'afnio (Af) con numero atomico Z=72.
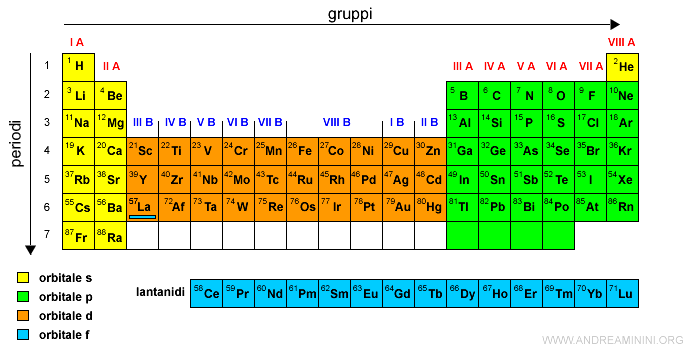
L'elemento successivo è l'attinio (At) con numero atomico Z=89.
Dopo l'attino seguono 14 elementi che si collocano nel sottolivello interno 5f.
Gli elementi di questa serie sono detti attinidi, dal nome dell'elemento che precede, e sono scritti sotto la tavola periodica.
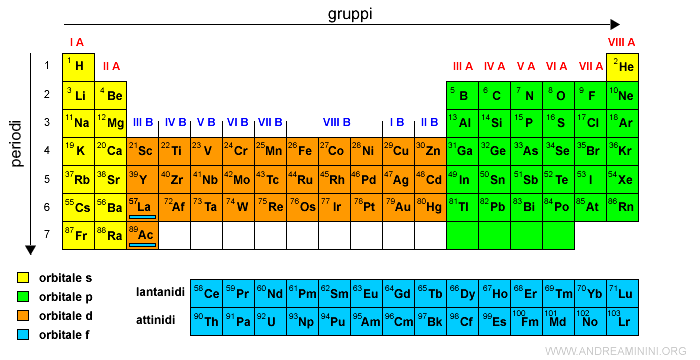
I successivi elementi chimici si collocano sui sottolivelli interni di tipo d e p completando la tavola periodica.
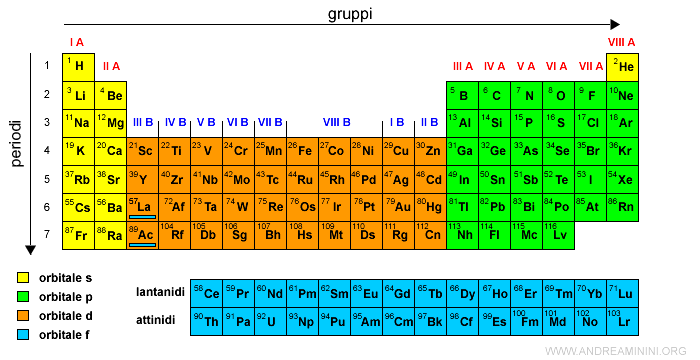
Al momento la tavola periodica è composta da 118 elementi chimici.
Gli ultimi elementi chimici sono artificiali ossia creati in laboratorio. Per molti non è ancora ufficiale il nome.
E via dicendo
I periodi
I periodi della tavola periodica hanno lunghezza differente.
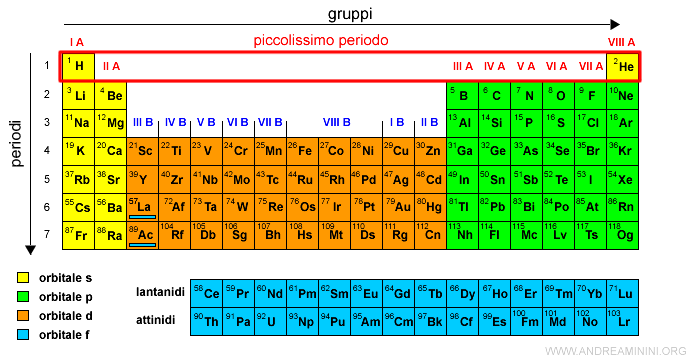
Il primo periodo
Il primo periodo è il più corto ha soltanto due elementi (H e He) perché gli elementi hanno gli elettroni soltanto nel primo orbitale di tipo s.
Rappresenta gli elementi del primo livello energetico (n=1).
E' anche detto piccolissimo periodo.
Il secondo e terzo periodo
Il secondo e il terzo periodo hanno otto elementi perché gli elementi hanno gli elettroni soltanto negli orbitali di tipo s e p.
Rappresentano rispettivamente gli elementi chimici del secondo (n=2) e del terzo (n=3) livello energitico.
Il secondo periodo è detto primo periodo corto.
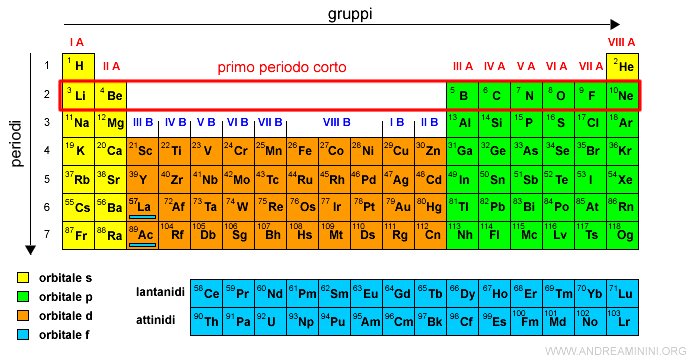
Il terzo periodo è detto secondo periodo corto.
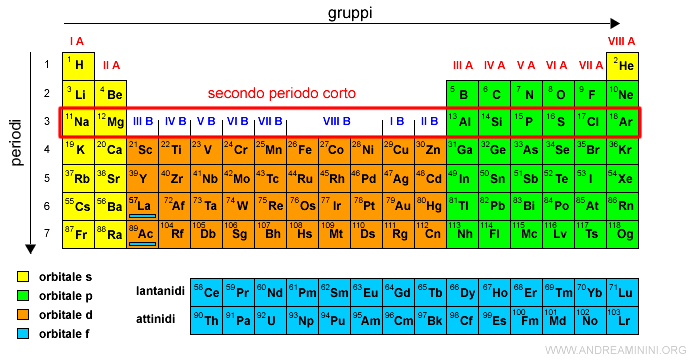
Il quarto e quinto periodo
Il quarto e il quinto periodo hanno 18 elementi, perché gli elementi hanno gli elettroni anche negli orbitali di tipo d.
Il quarto periodo è detto primo periodo lungo.
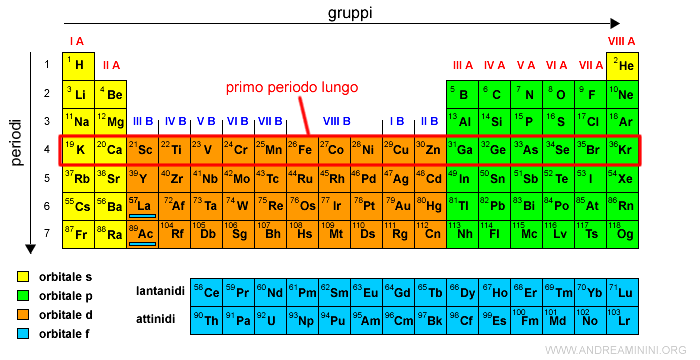
Il quinto periodo è detto secondo periodo lungo.
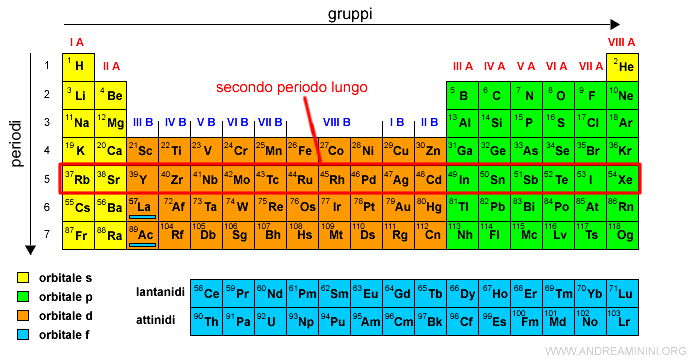
I 10 elementi del quarto periodo con gli elettroni negli orbitali di tipo d sono anche detti prima serie di transizione.

Nota. E' detta serie di transizione perché gli elettroni si collocano su un sottolivello più interno (3d) rispetto al livello di valenza/periodo (n=4).Il riempimento degli orbitali di tipo d è irregolare negli elementi di transizione a causa della vicinanza tra gli orbitali 4s e 3d, 5s e 4d, 6s e 5d. Per questa ragione alcuni elementi hanno configurazioni anomale con salti e sottolivelli incompleti che non seguono esattamente la progressione del numero atomico.
I 10 elementi del quinto periodo con gli elettroni negli orbitali di tipo d sono anche detti seconda serie di transizione.

Nota. La seconda serie di elementi di transizione si colloca sugli orbitali 3d, più interni rispetto al livello energetico del periodo (n=5).
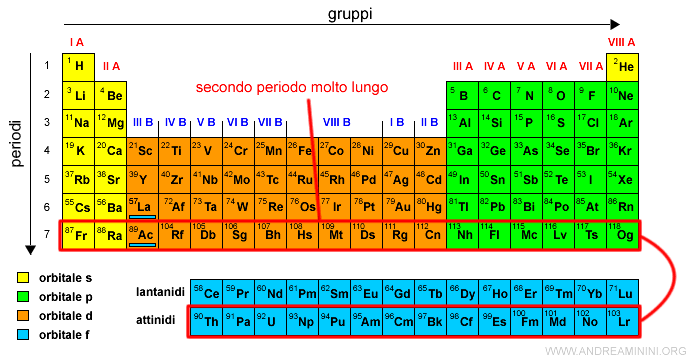
Il sesto periodo
Il sesto periodo ha 32 elementi perché contiene anche 14 elementi con gli elettroni negli orbitali di tipo f.
E' anche detto primo periodo molto lungo.

Nota. I 14 elementi negli orbitali di tipo f sono detti lantanidi perché seguono l'elemento chimico del lantanio (La).
Per evitare di allungare eccessivamente la tavola periodica, la serie dei lantanidi è rappresentata in una riga a parte, sotto la tavola periodica.
La serie dei lantanidi è anche detta prima serie di transizione interna.
I 10 elementi con gli orbitali di tipo d e i lantanidi formano la terza serie di transizione.

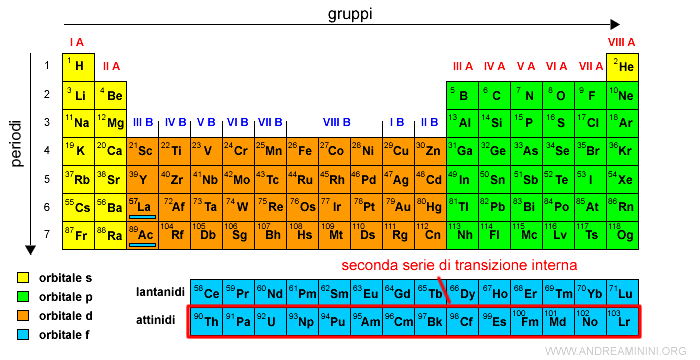
Il settimo periodo
Il settimo periodo ha 32 elementi perché contiene anche 14 elementi con gli elettroni negli orbitali di tipo f.
E' anche detto secondo periodo molto lungo.
Nota. I 14 elementi negli orbitali di tipo f sono detti attinidi perché seguono l'elemento chimico del attinio (Ac).
In modo analogo alla precedente riga, la serie degli attinidi è rappresentata in una riga a parte sotto la tavola periodica.
La serie degli attinidi è anche detta seconda serie di transizione interna.
Nota. Negli elementi di transizione interna (lantanidi e attinidi) si verificano diverse irregolarità nella distribuzione degli elettroni a causa della vicinanza degli orbitali 6s, 4f, 5d e 7s, 5f e 6d. Pertanto, nella configurazione elettronica il riempimento degli orbitali non segue esattamente la progressione del numero atomico.
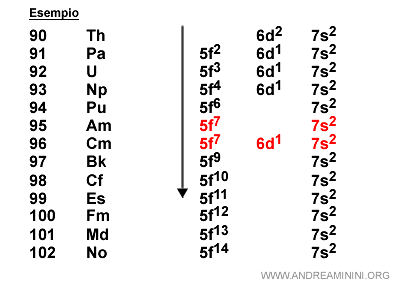
I 10 elementi con gli orbitali di tipo d e gli attinidi formano la quarta serie di transizione.

Nota. Il settimo periodo contiene molti elementi che non esistono in natura perché creati artificialmente in laboratorio. Questi elementi hanno un numero atomico superiore all'uranio (Z=92) e sono detti elementi transuranici.
I gruppi
I gruppi sono le colonne della tavola periodica, indicano gli elementi chimici con proprietà chimiche e fisiche simili.
Gli elementi che appartengono allo stesso gruppo (colonna) hanno lo stesso numero di elettroni esterni.
Al crescere del periodo (livello energetico) cresce anche il numero dei gruppi perché gli elettroni possono disporsi su più orbitali.
I gruppi sono suddivisi in due categorie
- Gruppi A (elementi tipici)
Sono anche detti elementi rappresentativi. Ogni gruppo è numerato da 1 a 8. Il numero del gruppo corrisponde agli elettroni di valenza. Ad esempio, gli elementi del gruppo VII A hanno tutti la configurazione elettronica esterna ns2np5. - Gruppi B (elementi di transizione)
Sono detti elementi di transizione perché gli ultimi elettroni si dispongono su un livello inferiore rispetto al periodo. Ad esempio, lo scandio (Sc) si trova al periodo 4, la sua configurazione elettronica superficiale è 4s2 3d1. Quindi, ha due elettroni sull'orbitale 4s2 e un elettrone sull'orbitale 3d1 (sottolivello inferiore rispetto a 4). Il numero di ogni sottogruppo B corrisponde al numero di elettroni presenti negli orbitali di tipo d. Salvo poche eccezioni.Nota. Gli elementi di transizione interna (lantinidi e attinidi) sono un sottogruppo del gruppo III B. Hanno gli ultimi elettroni che occupano progressivamente gli orbitali f di due unità inferiori rispetto al periodo. Ad esempio, il Cerio (Ce) ha la configurazione elettronica superficiale è 6s2 5d1 4f1.
Il gruppo VIII B comprende tre colonne perché i gruppi del ferro, cromo e nichel hanno molte analogie di comportamento.
Alcuni gruppi hanno anche una denominazione propria.
Il gruppo I A senza l'idrogeno è detto dei metalli alcalini.
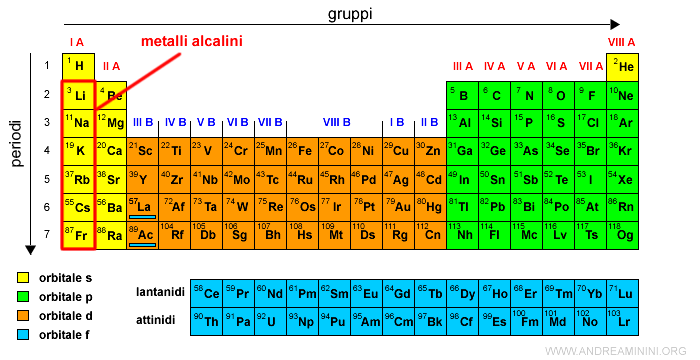
Nota. L'idrogeno ha un solo elettrone di tipo s ma possiede proprietà diverse dagli altri elementi del gruppo I A.
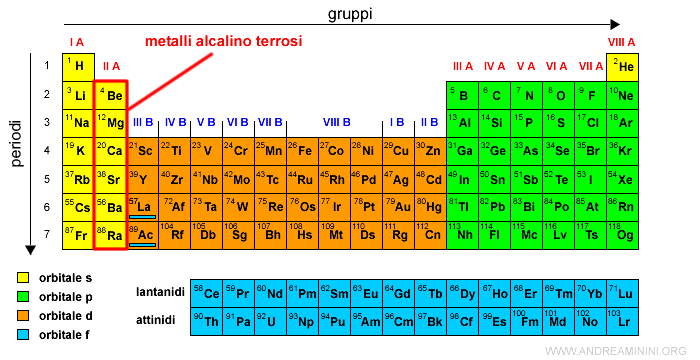
Il gruppo II A è detto dei metalli alcalino-terrosi.
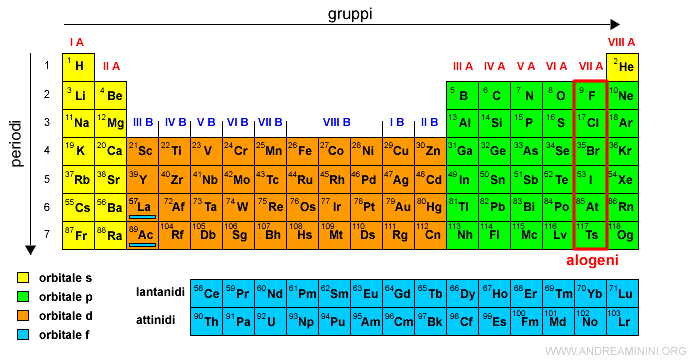
Il gruppo VII A è detto degli alogeni.
Il gruppo VIII A è detto dei gas nobili (o gas inerti).
Sono caratterizzati dalla saturazione degli orbitali s e p. Pertanto, non si legano con altri elementi chimici.
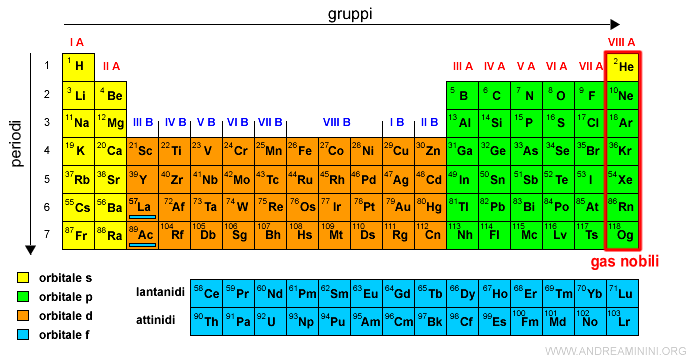
Nota. L'elio non ha nessun elettrone di tipo p ma possiede proprietà simili a quelle dei gas nobili. Per questa ragione si trova nel gruppo VIII A.
La configurazione elettronica degli elementi
La posizione di un elemento chimico nella tavola periodica consente di ottenere rapidamente la sua configurazione elettronica salvo rare eccezioni.

Esempio. Il titano (Ti) si trova nel gruppo IV B al periodo 4, questo vuol dire che nella sua configurazione elettronica esterna/superficiale ha due elettroni nell'orbitale 4s2 e 2 elettroni nell'orbitale 3d2 perché l'elemento si trova nella seconda colonna degli elementi di transizione.
La storia della tavola periodica
Nel XIX secolo diversi chimici si accorsero di alcune analogie tra le proprietà degli elementi chimici che si ripetevano con una certa regolarità e iniziarono a cercare la legge di periodicità.
Nota. Il tedesco Dobereiner si accorse che alcuni gruppi di tre elementi, detti triadi, avevano caratteristiche simili. Nel 1863 l'inglese J.Newlands propose un metodo di classificazione basato sul peso atomico che definì legge delle ottave.
La prima tavola periodica viene ideata nel 1869 dal chimico russo Mendeleev che ordinò gli elementi in base al loro peso atomico.
Mendeleev fece in modo che gli elementi con proprietà simili si trovassero nella stessa colonna della tavola.
Nota. Quando Mendeleev costruì la prima tavola periodica molti elementi chimici erano ancora sconosciuti. Il chimico russo si accorse delle irregolarità e lasciò appositamente delle caselle vuote per indicare gli elementi mancanti. Assegnò persino un nome alle caselle vuote (ekaboro, ekaalluminio, ekasilicio). Successivamente, furono scoperti gli elementi chimici mancanti con le proprietà indicate da Mendeleev. Erano lo scandio (ekaboro), il gallio (ekaalluminio) e il germanio (ekasilicio). Questo contribuì a dare notorietà alla tavola periodica.
Tuttavia, la tavola di Mendeleev aveva un problema: molti elementi chimici hanno isotopi di massa atomica differente.
Queste rendeva difficile la classificazione degli elementi.
Nel 1913, per risolvere il problema il chimico inglese Moseley propose di ordinare gli elementi chimici in funzione del loro numero atomico.
Perché è meglio il numero atomico?. Gli elementi chimici possono avere diversi isotopi, quindi diverse masse atomiche, ma sicuramente hanno un solo numero atomico che individua il numero di protoni ed elettroni.
Si giunse così all'attuale tavola periodica degli elementi.
E così via
