Legame covalente
Cos'è il legame covalente
Il legame covalente è un legame chimico in cui ogni atomo mette in comune uno o più elettroni. Si forma tra atomi con elettronegatività uguale o comparabile.
Nel legame covalente gli atomi condividono una coppia di elettroni o più coppie detti doppietti, per raggiungere la configurazione esterna stabile dei gas nobili ( ottetto ).
Le coppie di elettroni che formano il legame sono dette coppie di legame.
Nota. Le coppie di elettroni di valenza non condivise, quelle che non partecipano al legame, sono invece dette coppie solitarie (o lone pairs). Ad esempio, in una molecola di fluoro $ F_2 $ ci sono due atomi di fluoro e ogni atomo mette a disposizione dell'altro un elettrone, in questo modo grazie ai due elettroni in comune entrambi gli atomi raggiungono la stabilità (8 elettroni) nella configurazione esterna.
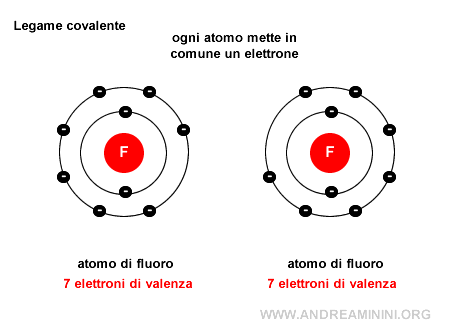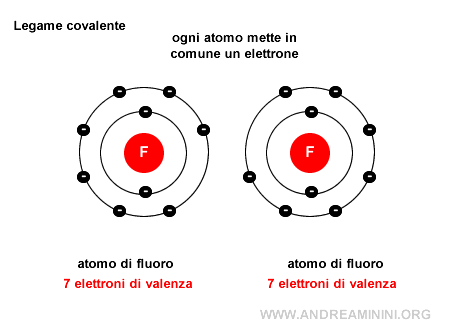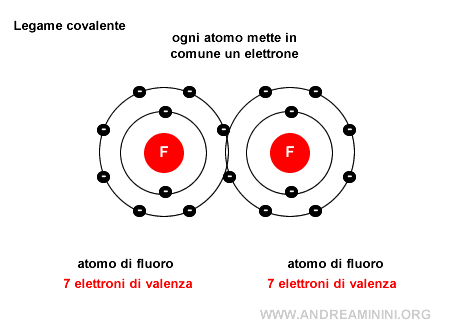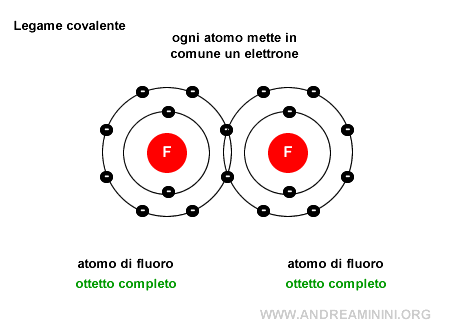
Un esempio pratico
L'ossigeno molecolare è composto da due atomi di ossigeno atomico (O).
$$ O + O \rightarrow O_2 $$
Gli atomi di ossigeno hanno la configurazione elettronica superficiale 2s2 2p4 con 6 elettroni di valenza.
Pertanto hanno bisogno di altri due elettroni per raggiungere l'ottetto.
Nel legame covalente ogni atomo di ossigeno mette in comune due elettroni di valenza.
Quindi, in tutto sono quattro elettroni spaiati.
Si formano due coppie di elettroni ossia due doppietti.

Grazie agli elettroni di valenza in comune entrambi gli atomi di ossigeno completano l'ottetto.
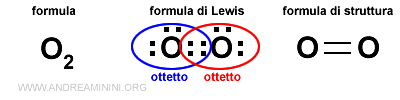
In questo modo entrambi gli atomi di ossigeno raggiungono la configurazione elettronica stabile 2s2 2p6 del gas nobile più vicino, il neon
Come rappresentare i legami covalenti
In genere per rappresentare i legami covalenti si usano le strutture di Lewis o le formule di struttura.
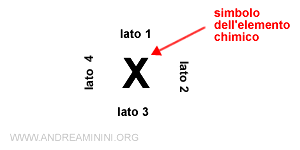
Il nucleo e gli elettroni più interni sono rappresentati dal simbolo dell'elemento chimico.
Ogni lato indica un orbitale della configurazione superficiale ns np.
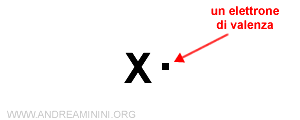
Gli elettroni di valenza (più esterni) sono invece rappresentati con dei puntini ai lati del simbolo.
Per indicare il legame covalente si scrivono i due simboli separati dalle coppie di elettroni che hanno in comune.

Il legame covalente singolo e multiplo
Il legame covalente è detto
- Legame covalente singolo
Se in comune c'è una sola coppia di elettroni. Ad esempio, l'idrogeno molecolare.

- Legame covalente multiplo
Se in comune ci sono due o più coppie di elettroni. Può essere doppio, triplo, ecc.- Legame covalente doppio
Se ci sono due coppie di elettroni in comune. Ad esempio, l'ossigeno molecolare.

- Legame covalente triplo
Se ci sono tre coppie di elettroni in comune. Ad esempio, l'azoto molecolare.

- Legame covalente doppio
Tipi di legami covalenti
Esistono tre tipi di legami covalenti:
- Legame covalente puro (omopolare)
Si realizza tra atomi dello stesso elemento chimico. - Legame covalente polare (eteropolare)
Si realizza tra atomi di elementi chimici diversi. - Legame covalente dativo
La coppia di elettroni viene messa in comune da un solo atomo.
La lunghezza di legame
La lunghezza di legame è la distanza tra i nuclei degli atomi legati.
La lunghezza di legame si riduce al formarsi delle coppie di legame tra gli atomi.
Esempio. Un legame triplo è più corto rispetto a un legame doppio. A sua volta un legame doppio è più corto di un legame semplice. In un legame singolo la lunghezza di legame può essere approssimata sommando i raggi atomici degli elementi.
Quanto più corta è la distanza di legame, tanto maggiore è l'energia di legame tra gli atomi.
La teoria del legame covalente
La teoria del legame covalente nasce nei primi decenni del XX secolo.
Secondo la teoria del legame covalente due atomi tendono a legarsi tra loro per raggiungere una configurazione elettronica più stabile, quella del gas nobile più vicino per numero atomico.
Si deve agli studi di W.Kossel e G.N.Lewis nel 1916 che, indipendentemente l'uno dall'altro, nei primi decenni del XX secolo formularono una teoria simile.
- Kossel si occupò principalmente dei composti ionici. Secondo Kossel due elementi chimici si combinano tra loro più facilmente, quanto più si trovano lontani nella tavola periodica.
Nota. Pertanto, nel modello di Kossel due atomi vicini o dello stesso tipo hanno più difficoltà a legarsi l'uno all'altro.
- Lewis studiò il problema più in generale con la teoria del legame di valenza (VB). Secondo Lewis la formazione di un legame chimico tra due atomi è determinata dalla condivisione di una coppia di elettroni di valenza. Gli elettroni più interni non son coinvolti (struttura elettronica interna invariata). La messa in comune di una o più coppie di elettroni è detta legame covalente. Può avvenire tra atomi dello stesso elemento chimico o tra atomi di elementi diversi.
Nota. Lewis ideò anche una notazione per rappresentare la configurazione elettronica superficiale di un atomo, detta simboli o strutture di Lewis.
Oggi la teoria del legame covalente è attribuita soprattutto a Lewis.
Non è comunque l'unica teoria del legame in grado di interpretare i legami chimici.
E così via.
