Diagramma di stato
Cos'è un diagramma di stato
Un diagramma di stato rappresenta lo stato fisico di una sostanza pura al variare della temperatura (T) e della pressione (P). E' anche detto diagramma di fase.
A cosa serve?
E' una rappresentazione sintetica delle fasi di una sostanza e delle pressioni/temperature di equilibrio dinamico.
Dove per fase si intende una parte di una sostanza che è uguale per stato fisico e composizione chimica ed è separata in modo netto dalle altri parti della sostanza.
Esempio. Una pentola a pressione (sistema chiuso) è riempita per metà d'acqua. Una parte delle molecole d'acqua evapora passando allo stato aeriforme del vapore. Altre restano allo stato liquido. Nella pentola si formano due parti ben distinte tra loro, dette fasi, caratterizzate da molecole con la stessa composizione chimica e lo stesso stato fisico.
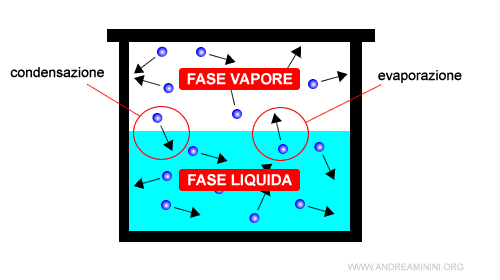
Le principali fasi della materia sono le seguenti:
- solido
- liquido
- vapore
Come leggere il diagramma di stato
Quando il diagramma di stato riguarda una sostanza pura (sistema a un componente) si indica sull'asse dell'ascisse la temperatura e sull'asse delle ordinate la pressione.
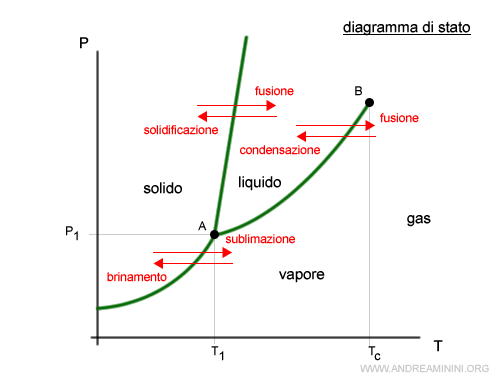
Le linee che separano le regioni delle fasi (solido, liquido, vapore) nel diagramma di stato indicano le combinazioni di pressione e temperatura in cui si verifica un equilibrio dinamico.
Per equilibrio dinamico si intende una particolare circostanza in cui la transizione da una fase a un'altra è uguale alla transizione opposta.
Esempio. In un sistema chiuso l'equilibrio dinamico si presenta quando la transizione di fase di un liquido al vapore (evaporazione) è uguale alla transizione di fase del vapore al liquido (condensazione). Nel diagramma di stato questo si verifica sulla linea di confine (verde) tra la fase liquida e la fase vapore. Si parla di equilibrio "dinamico" perché i flussi sono continui ma si bilanciano tra loro, la velocità di evaporazione e la velocità di condensazione si eguagliano. Pertanto, la quantità di molecole nella fase liquida e la quantità di molecole nella fase vapore sono costanti nel tempo.
Il punto A indica la combinazione di pressione e temperatura in cui la materia comincia a presentarsi allo stato liquido. E' detto punto triplo perché coesistono tre fasi in equilibrio.
Il punto B è la temperatura critica oltre la quale la materia cessa di esistere allo stato vapore e comincia a comportarsi come un gas.
Ogni sostanza chimica ha un proprio diagramma di stato caratteristico.
Nota. I punti di equilibrio dinamico nella curva del diagramma di stato sono determinati dall'equazione di Clausius-Clapeyron.
La tensione di vapore del solido e del liquido
La curva che separa la fase solida da quella aeriforme misura la tensione di vapore del solido al variare della temperatura.
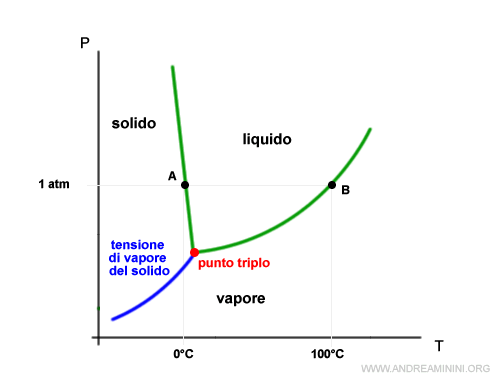
E' rappresentata dalla formula di Clapeyron
$$ P = C \cdot e^{\frac{\Delta H_{sub}}{RT} } $$
Dove ΔHev è la variazione dell'entaplia di sublimazione.
La curva che separa la fase liquida da quella aeriforme misura la tensione di vapore del liquido al variare della temperatura.
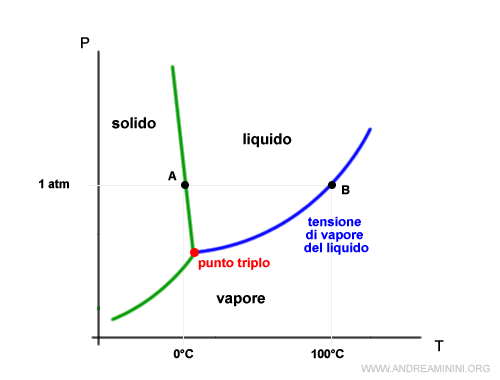
E' rappresentata dalla formula di Clapeyron
$$ P = C \cdot e^{\frac{\Delta H_{ev}}{RT} } $$
Dove ΔHev è la variazione dell'entaplia di evaporazione.
La curva di equilibrio dinamico tra gli stati solido-liquido
è rappresentata dalla seguente formula
$$ \frac{dP}{dT} = \frac{\Delta H_{fus}}{T \Delta V} $$
Dove ΔHfus è la variazione di entalpia e ΔV è la variazione del volume della materia nel passaggio di stato.
La variazione di entalpia è sempre positiva ( ΔHfus>0) .
La variazione del volume, invece, può essere positiva o negativa.
Il segno della variazione del volume (ΔV) determina la pendenza positiva o negativa della curva.
Esempio. Quando l'acqua passa dallo stato solido (ghiaccio) a liquido riduce il proprio volume (ΔVV<0). Quindi, nel processo di fusione dell'acqua la pendenza della curva di equilibrio solido-liquido è negativa.
Come costruire un diagramma di stato
Per disegnare un diagramma di stato in un sistema con un componente (una specie chimica) si pone una mole di una sostanza pura in un sistema chiuso.
Poi si fornisce una piccola quantità di calore al sistema e si aspetta che raggiunga l'equilibrio nei valori della pressione (P) e della temperatura (T).
Una volta raggiunto l'equilibrio, si fornisce al sistema un'ulteriore quantità di calore e si ricomincia daccapo.
In questo modo si disegna gradualmente la curva di equilibrio del diagramma di stato in tutti i suoi valori di equilibrio.
I punti bivarianti, monovarianti e il punto triplo
Ogni punto del piano del diagramma di stato è una particolare combinazione di temperatura (T) e pressione (P).
In un diagramma di stato esistono tre tipologie di punti.
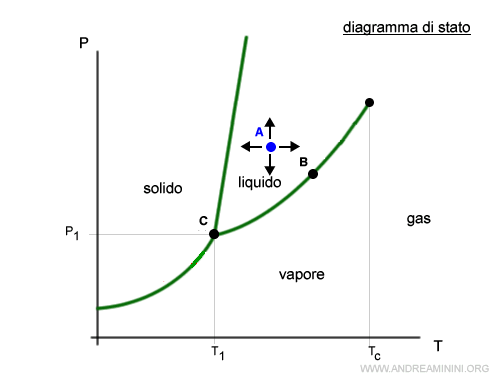
- Bivarianti
Nei punti bivarianti, entro certi limiti la variazione della temperatura e/o della pressione non cambia lo stato fisico della materia. Ad esempio, nel punto A posso variare sia la temperatura che la pressione senza modificare lo stato di aggregazione della materia.
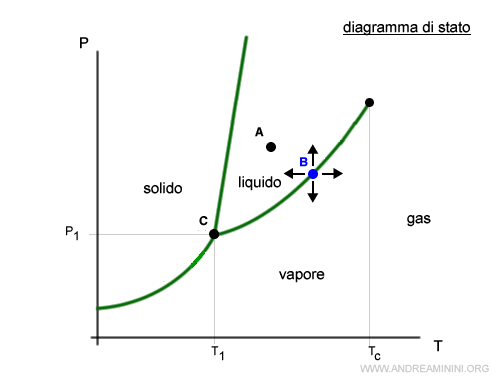
- Monovarianti
Nei punti monoavarianti, fissata la temperatura esiste un solo valore della pressione che consente l'equilibrio senza modificare lo stato fisico di aggregazione della materia. E viceversa. Ad eccezione del punto triplo, tutti i punti sulle curve che separano le fasi sono monovarianti. Ad esempio, nel punto B una piccola variazione della pressione o della temperatura causa il passaggio dallo stato liquido ad aeriforme o viceversa.
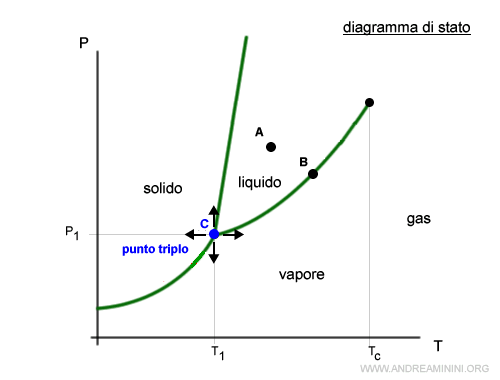
- Punto triplo
Il diagramma di stato è caratterizzato anche da un particolare punto detto "punto triplo" in cui coesistono tre stati di aggregazione (liquido, solido e gassoso). Si tratta del punto C. In questo caso, qualsiasi variazione della temperatura o della pressione causa la scomparsa di almeno una fase.
Un esempio pratico
Esempio 1 (acqua)
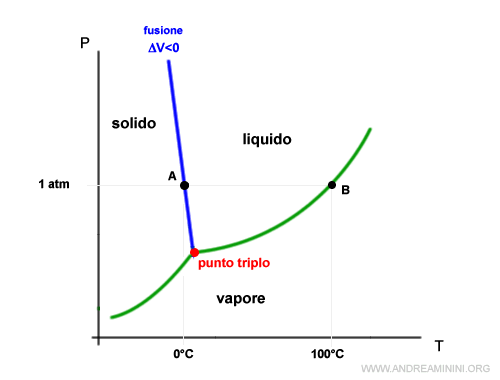
Prendo come esempio il diagramma di stato dell'acqua.
Il diagramma suddivide il piano in tre regioni diversa, ognuna delle quali identifica uno stato di aggregazione dell'acqua.
- solido (ghiaccio)
- liquido
- aeriforme (vapore)
Ad esempio, in condizioni di temperatura e pressioni del punto C l'acqua si trova allo stato liquido.
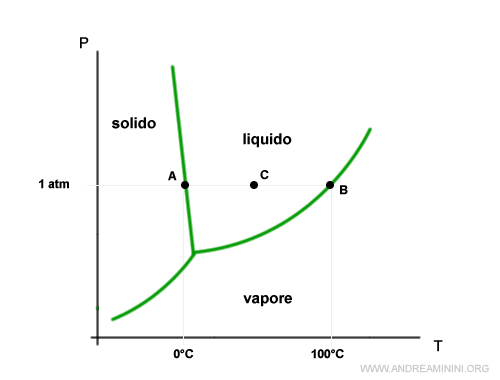
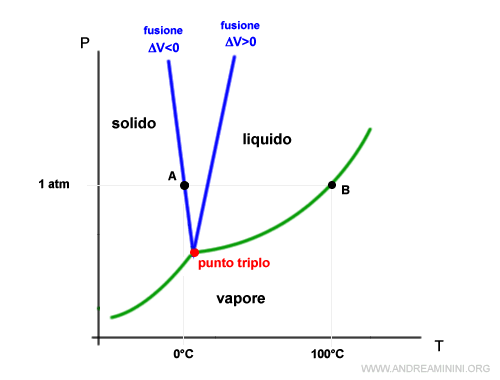
Traccio una retta a parità di pressione (curva isobara) in corrispondenza di 1 atm (760 torr).
La retta interseca le curve del diagramma di stato nei punti A e B individuando rispettivamente la temperatura di fusione (0°C) e di temperatura di ebollizione (100°C) dell'acqua in condizioni ambientali normali (al livello del mare).
Al di sotto di 0°C l'acqua è stabile allo stato solido, tra 0°C e 100°C l'acqua è stabile allo stato liquido, oltre i 100°C l'acqua è stabile allo stato aeriforme (vapore).
Se la pressione è più alta la temperatura di fusione si riduce mentre quella di ebollizione aumenta.
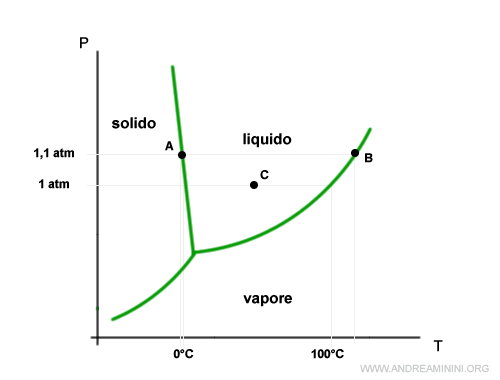
Viceversa, se la pressione è più bassa la temperatura di fusione aumenta mentre quella di ebollizione si riduce.
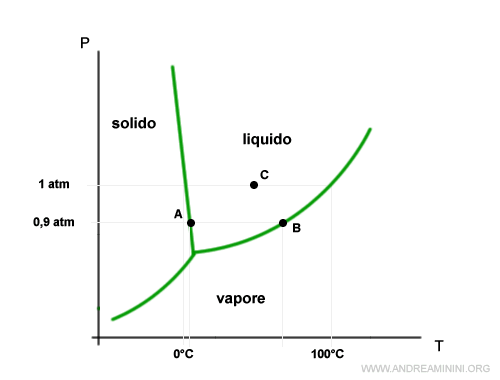
Se la pressione è al di sotto del punto triplo scompare la temperatura di fusione, perché l'acqua passa di stato direttamente dallo stato solido ad aeriforme (e viceversa).
Ad esempio, nel punto D il sistema è bivalente tra la fase solida e aeriforme. Non c'è la fa fase liquida.
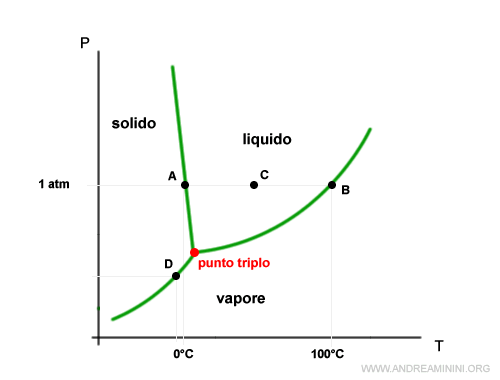
Nel punto triplo la tensione di vapore del solido e del liquido sono uguali.
La pendenza della curva di equilibrio tra gli stati solido-liquido dell'acqua ha pendenza negativa perché l'acqua liquida ha un volume inferiore all'acqua solida (ghiaccio).
Esempio. In un recipiente chiuso ho acqua e ghiaccio. Poi comprimo il recipiente. Per il principio di Le Chatelier la riduzione del volume (sollecitazione esterna) causa per reazione il passaggio allo stato fisico che occupa meno volume. Nel caso dell'acqua è lo stato liquido. Quindi, il ghiaccio diventa acqua liquida. La fusione è un processo endotermico (ΔH>0), le molecole rallentano il proprio moto e la temperatura si riduce.
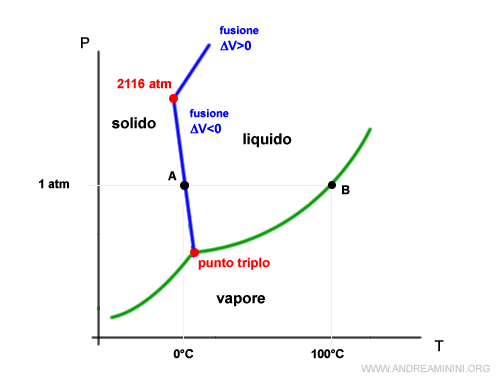
La pendenza negativa della curva solido-liquido dell'acqua ha comunque a una pressione massima di 2115 atm, oltre la quale la curva assume una pendenza positiva.
Questo accade perché a pressioni altissime si formano strutture cristalline differenti da quelle del ghiaccio con volume inferiore a quelle dell'acqua liquida.
La pendenza della curva di equilibrio solido-vapore (tensione vapore del solido) dell'acqua è invece sempre positiva.

Anche la pendenza della curva di equilibrio liquido-vapore (tensione vapore del liquido) è positiva.

Tuttavia, la tensione vapore dell'acqua allo stato liquido si interrompe a 374,1°C detta temperatura critica.
Al di sopra della temperatura critica l'acqua cessa di esistere allo stato liquido.
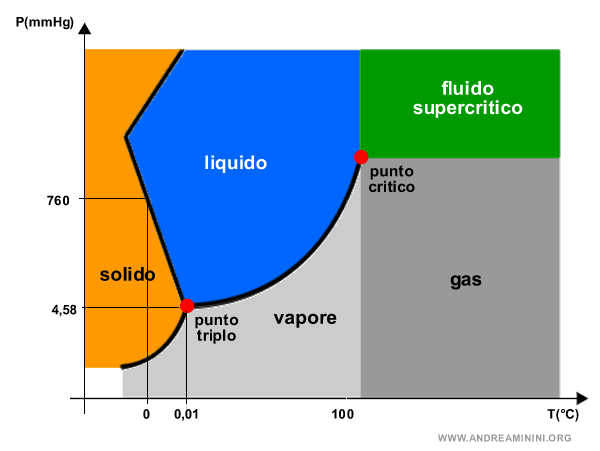
Nota. In equilibrio dinamico la temperatura critica di 374,1°C è associata a una pressione di 218 atm detta pressione critica.
Oltre la temperatura critica l'acqua diventa un fluido supercritico se la pressione è oltre 218 atm, oppure si comporta come un gas se la pressione è inferiore.
Lo stato fluido è uno stato fisico in cui la materia con comportamento simile sia ai gas che ai liquidi.
Esempio 2 (biossido di carbonio)
Il diagramma di stato del biossido di carbonio ha il punto triplo in equilibrio dinamico a -56,6°C di temperatura e 5,1 atm di pressione.
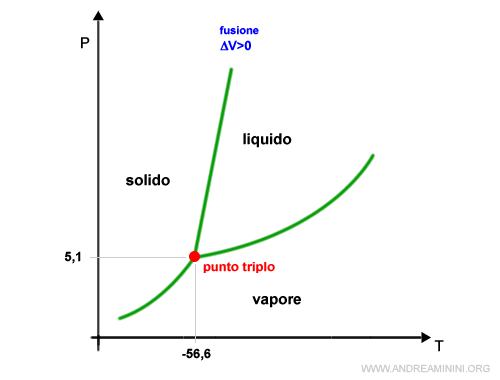
Essendo il punto triplo superiore alla pressione atmosferica, la CO2 si presenta normalmente allo stato aeriforme.
In condizioni ambientali normali (20°C e 1 atm) la CO2 non esiste allo stato liquido.
Nota. A volte la CO2 è usata allo stato solido come ghiaccio secco, come refrigerante o per creare l'effetto nebbia. La CO2 allo stato solido in condizioni ambientali sublima da solido ad aeriforme.
Il diagramma di stato del biossido di carbonio è caratterizzato da una curva con pendenza positiva al confine tra la fase solida e liquida.
Quindi, la relazione tra pressione e temperatura nell'equilibrio solido-liquido è crescente.
Nel processo di fusione l'anidride carbonica aumenta il proprio volume.
Pertanto, il volume della CO2 allo stato liquido è superiore al volume allo stato solido (ΔV>0).
Nota. A parte l'acqua e altre poche sostanze, gran parte delle sostanze espandono il proprio volume durante il processo di fusione.
Il fenomeno è spiegabile con la teoria dell'equilibrio mobile di Le Chatelier.
Se in un recipiente chiuso contenente CO2 allo stato liquido si riduce il volume (sollecitazione esterna) aumenta la pressione (effetto).
In reazione all'aumento di pressione la CO2 passa allo stato fisico con minore volume, ossia allo stato solido.
La solidificazione è un processo esotermico ossia con cessione di calore (ΔH<0) che aumenta la temperatura.
E così via.
