L'evaporazione
Cos'è l'evaporazione
L'evaporazione è il passaggio dallo stato liquido allo stato aeriforme delle particelle di un liquido. Il fenomeno si verifica a tutte le temperature.
Qual è la causa dell'evaporazione
Quando una particella allo stato liquido raggiunge la superficie e ha sufficiente energia cinetica per vincere le forze attrattive delle altre particelle, fuoriesce dal liquido passando allo stato aeriforme (vapore).
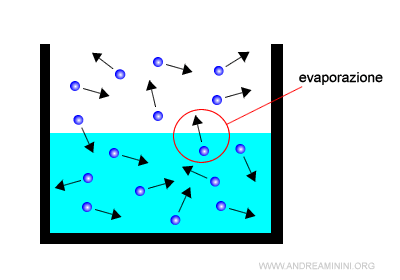
Il fenomeno contrario dell'evaporazione è la condensazione (passaggio da vapore a liquido).
La relazione tra evaporazione, calore e temperatura
L'evaporazione di un liquido aumenta con la temperatura.
Al crescere della temperatura, la maggiore quantità di calore aumenta la velocità (energia cinetica) delle particelle.
La maggiore velocità delle particelle aumenta il numero delle particelle che vincono le forze attrattive delle altre particelle sulla superficie del liquido (evaporazione).
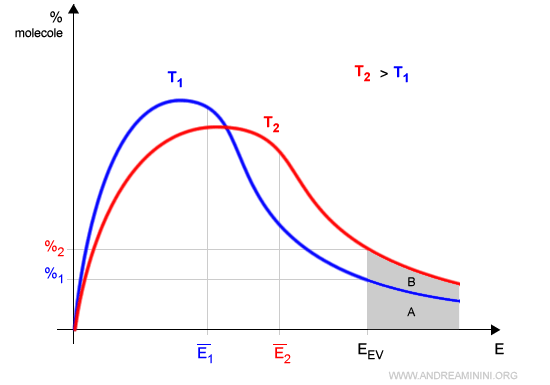
Spiegazione. Alla temperatura T1 le molecole del liquido hanno un'energia cinetica media pari a E1. Le molecole che si muovono abbastanza velocemente da evaporare sono pari alla superficie A. Alla temperatura T2, più grande di T1, le molecole del liquido hanno un'energia cinetica media superiore (E2). In questo caso le molecole con sufficiente energia da evaporare sono molte di più, pari alla superficie A+B.
Il calore necessario per far evaporare completamente un'unità di massa del liquido è detto calore latente di vaporazione.
Il calore latente di vaporizzazione è uguale al calore latente di condensazione.
Nota. Il calore latente di condensazione è il calore rilasciato da una massa unitaria di vapore quando torna allo stato liquido (condensazione). E' il fenomeno opposto dell'evaporazione.
L'evaporazione e il raffreddamento dei liquidi
Il fenomeno dell'evaporazione è la causa del raffreddamento del liquido.
A causa dell'evaporazione le particelle con più energia passano dallo stato liquido allo stato vapore.
Quindi, l'energia media delle particelle che restano nel liquido si riduce nel tempo.
- Se il sistema è aperto (es. bicchiere) il volume del liquido si riduce fino a scomparire del tutto.
- Se il sistema è chiuso (es. termos) il volume del liquido si stabilizza a un livello costante in corrispondenza dell'equilibrio dinamico tra evaporazione (da liquido a vapore) e condensazione (da vapore a liquido). E' detto equilibrio dinamico liquido-vapore.
Altro esempio. Il sudore umano è un sistema di raffreddamento del corpo. Quando aumenta la temperatura, aumenta la sudorazione per effetto dell'evaporazione dei liquidi. Grazie alla sudorazione, il corpo umano cede il calore all'esterno, mantenendo costante la temperatura corporea.
L'equilibrio dinamico tra liquido e vapore in un sistema chiuso
L'evaporazione riduce il numero delle particelle del liquido.
Tuttavia, in un sistema chiuso (es. termos) il numero delle particelle allo stato liquido e aeriforme è costante, perché le particelle passate allo stato di vapore non si disperdono nell'ambiente esterno.
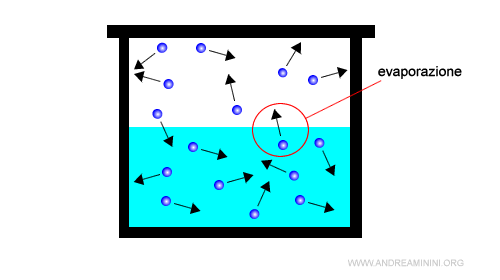
L'evaporazione aumenta la pressione interna del contenitore, perché allo stato aeriforme una sostanza ha un volume maggiore.
Se le particelle allo stato vapore collidono con la superficie dell'acqua o le pareti del contenitore, perdono energia cinetica.
Avendo minore energia, le particelle formano dei legami con le altre particelle tornando allo stato liquido (condensazione).
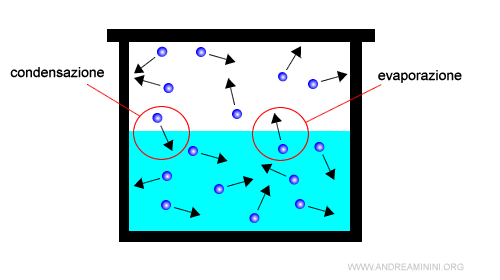
Quindi, in un sistema chiuso si verificano simultaneamente due flussi opposti:
- Evaporazione
Una quantità di particelle passano dallo stato liquido allo stato vapore. - Condensazione
Una quantità di particelle passano dallo stato vapore allo stato liquido.
Nel tempo il sistema raggiunge un equilibrio dinamico tra evaporazione e condensazione detto equilibrio liquido-vapore.
Quando il sistema raggiunge l'equilibrio dinamico liquido-vapore le quantità di molecole nella fase liquida e nella fase vapore sono costanti, perché la velocità di evaporazione (vev) è uguale alla velocità di condensazione (vc). $$ v_{ev} =v_c $$
Si parla di equilibrio "dinamico" perché il flusso di evaporazione e condensazione è continuo nel tempo.
Nell'equilibrio dinamico il flusso di particelle che evaporano dal liquido è uguale a quello delle particelle che condensano.
Cos'è una fase? Una fase è una parte del sistema che si presenta nello stesso stato fisico e composizione chimica mentre il resto del sistema è difforme. Le diverse fasi del sistema sono separate tra loro da confini ben definiti. Ad esempio, l'acqua in una pentola a pressione sul fuoco è in parte liquida (fase liquida) e in parte aeriforme (fase vapore).
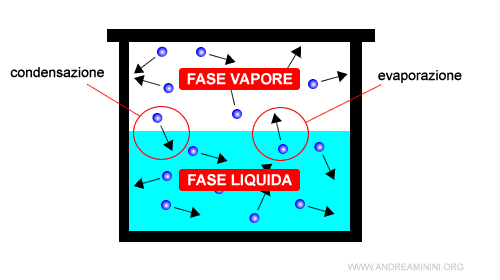
Il passaggio spontaneo da una fase all'altra si verifica in particolari condizioni di temperatura e pressione ed è detto transizione di fase. Un sistema termodinamico è monofase se è costituito da una sola fase, multifase se è costituito da più fasi.
Per questa ragione in un termos il liquido non evapora mai completamente e conserva più a lungo nel tempo la propria temperatura iniziale (fredda o calda).
La quantità di valore presente nel contenitore in equilibrio dinamico è detto vapore saturo.
Altre considerazioni utili:
- In equilibrio dinamico liquido-vapore il valore dell'energia libera del vapore (GV) è uguale a quella del liquido (GL). $$ \Delta G = G_V - G_L = 0 $$
- In equilibrio dinamico, a una data temperatura la pressione del vapore è costante nel tempo. Ad esempio, ecco il diagramma di stato dell'acqua.
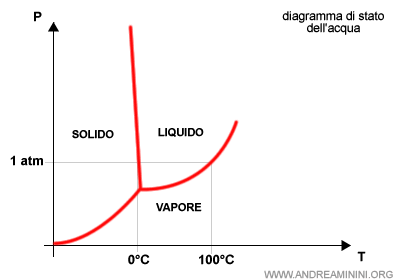
Nota. La variazione della temperatura lungo la curva di equilibrio tra due fasi di una sostanza è definita tramite l'equazione di Clasius-Clapeyron.
- La quantità di calore necessaria per portare una mole di un liquido alla fase gassosa è uguale alla variazione di entalpia molare di evaporazione (ΔHev).
- In termodinamica l'equilibrio dinamico liquido-vapore si verifica quando è soddisfatta la seguente condizione di stabilità $$ dG = V(dP) - S(dV) $$ Dove G è l'energia libera, V è il volume, P è la pressione, S è l'entropia.
Dimostrazione della condizione di stabilità dell'equilibrio. Sapendo che la formula dell'energia libera è $$ G = H-T \cdot S $$ Dove H è l'entalpia, T la temperatura assoluta e S è l'entropia. In questo caso è la variazione assoluta di energia libera DG. Quindi derivo la formula dell'energia libera
![$$ dG = dH - d(TS) \\ dG = dH - [(dT)S + T(dS) ] \\ dG = dH - S(dT) - T(dS) $$](https://www.andreaminini.org/data/andreamininiorg/evaporazione-dim-1.gif)
Considerando un processo reversibile con lavoro esclusivamente PV (pressione per volume) l'entalpia è la somma tra l'energia interna (E) e il prodotto tra pressione e volume (PV) ossia H=E+PV
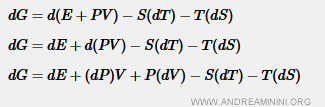
Per il primo principio della termodinamica la variazione di energia interna è ugualle alla differenza tra il calore (Q) e il lavoro (L) scambiato con l'ambiente E = Q - L.
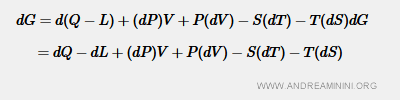
Per l'ipotesi iniziale il lavoro è L=PV con la pressione costante (dP=0), quindi la derivata dL = d(PV) = (dP)V + P(dV) = 0V + P(dV) = P(dV). $$ dG = dQ - P(dV) + (dP)V + P(dV) - S(dT) - T(dS) $$ In questo modo posso semplificare l'equazione eliminando +P(dV)-P(dV) $$ dG = dQ + (dP)V - S(dT) - T(dS) $$ In un processo reversibile la variazione di entropia è dS=dQ/T. Mettendo in evidenza dQ ottengo dQ=T(dS) e lo sostituisco nella formula dell'energia libera $$ dG = T(dS) + (dP)V - S(dT) - T(dS) $$ Questo mi permette di semplificare ulteriormente T(dS)-T(dS) $$ dG = (dP)V - S(dT) $$ E' la condizione di stabilità dell'equilibrio dinamico.
La pressione del vapore nei punti della curva in equilibrio dinamico è detta tensione vapore.
Il fenomeno dell'evaporazione si verifica anche nei solidi ma con livelli di tensione vapore molto più bassi.
Pertanto, esistono due tipi di tensione vapore:
- Tensione di vapore del solido
E' la pressione del vapore nel tratto della curva che separa la fase solida e la fase vapore. - Tensione di vapore del liquido
E' la pressione del vapore nel tratto della curva che separa la fase liquida e la fase vapore.
L'ebollizione
L'ebollizione è il passaggio impetuoso dallo stato liquido allo stato aeriforme (vapore) quando l'evaporazione si verifica in tutta massa del liquido.
All'interno del liquido si formano delle bolle d'aria che si saturano di vapore.
Quando la pressione in una bolla diventa superiore alla pressione del gas sovrastante, la bolla sale rapidamente verso la superficie del liquido, dove si rompe liberando il vapore.
L'ebollizione si verifica a una particolare temperatura detta punto di ebollizione in condizioni ambientali di pressione (1 atm) e in tutta la massa del liquido.
Quando il liquido raggiunge il punto di ebollizione, un ulteriore incremento del calore non aumenta la temperatura del liquido ma soltanto la velocità della trasformazione in vapore.
Il punto di ebollizione varia da liquido a liquido.
Esempio. L'acqua ha un punto di ebollizione pari a 100°C in condizioni ambientali di pressione (1 atm o 750 mmHg).
La temperatura di ebollizione di un liquido varia anche a seconda della pressione esterna.
Quando la pressione aumenta, la temperatura di ebollizione di un liquido è più alta. E viceversa.
Esempio. Se la pressione aumenta a 816 mmHg, il punto di ebollizione dell'acqua sale a 102°C di temperatura. Viceversa, se la pressione scende a 707 mmHg, il punto di ebollizione si riduce a 98°C di temperatura.
E così via.
