Il primo principio della termodinamica
Cosa dice il primo principio della termodinamica
La variazione di energia interna ΔE in un sistema chiuso, dovuta a una trasformazione, è pari alla differenza tra il calore (Q) e il lavoro (L) scambiato con l'ambiente $$ ΔE = Q - L $$
Per convenzione:
- Il segno sul calore è positivo (ΔQ>0) se il sistema assorbe calore dall'esterno, è negativo (ΔQ<0) se cede calore all'esterno.
- Il segno sul lavoro è positivo (ΔL>0) se il sistema sta compiendo un lavoro verso l'esterno, è negativo (ΔL<0) se riceve un lavoro dall'esterno.
Nota. Si tratta comunque di una convenzione. In alcuni libri di testo si usa una convenzione dei segni diversa, indicando con i valori positivi (ΔQ,ΔL>0) l'acquisto di calore e di lavoro, mentre con i segni negativi (ΔQ,ΔL<0) la cessione di calore e di lavoro. $$ ΔE = Q + L $$
La spiegazione
Il primo principio della termodinamica è un'applicazione del principio di conservazione dell'energia
L'energia totale di un sistema isolato è sempre costante.
Questo vuol dire che l'energia non può essere né creata, né distrutta, ma solo trasformata.
Esempio. Un vaso su un balcone ha un'energia potenziale Ep dovuta alla sua posizione. Quando il vaso cade, l'energia potenziale si trasforma in energia cinetica Ec dovuta al movimento. L'energia interna Ep+Ec del vaso è sempre la stessa.
In un sistema chiuso l'energia si presenta sotto forma di lavoro e calore.
Pertanto, l'energia interna del sistema E è pari alla somma del lavoro e del calore.
$$ E = Q + L $$
Nota. L'energia interna di un sistema non può essere misurata in valore assoluto. E' comunque possibile misurare le variazioni di energia causata da una trasformazione di stato. Quindi, l'energia interna è una funzione di stato, perché il suo valore dipende dalle variazioni dello stato finale e iniziale del sistema. Non dipende dal modo in cui avvengono le trasformazioni.
Durante una trasformazione di stato l'energia interna del sistema può variare.
$$ ΔE = E_{fine} - E_{inizio} $$
Ciò vuole dire che il sistema scambia l'energia con l'ambiente esterno.
- Se ΔE>0 il sistema assorbe energia
- Se ΔE<0 il sistema cede energia
Nota. In una reazione chimica la variazione di energia è pari alla differenza tra l'energia del prodotto (Ep) meno l'energia dei reagenti (Er) $$ ΔE = E_p - E_r $$
Il calore di reazione
Il calore di reazione è il calore Q scambiato tra il sistema e l'ambiente in una reazione chimica.
La reazione chimica è
- esotermica
se libera il calore verso l'esterno - endotermica
se assorbe il calore dall'esterno
Un esempio pratico
In questo esempio considero la convenzione di segno
$$ ΔE = Q - L $$
Due recipienti sferici rigidi di vetro sono collegati tra loro da un rubinetto e immersi in acqua.
Un recipiente contiene una mole di gas ideale mentre l'altro è vuoto.

Aprendo il rubinetto il gas occupa tutto il volume disponibile.
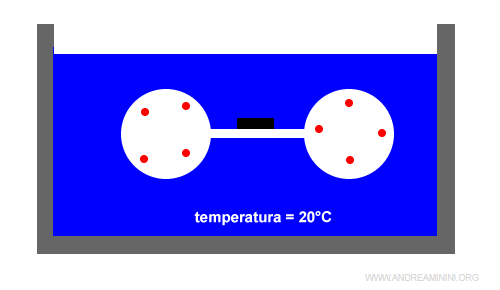
L'espansione del gas produce un lavoro (L) pari all'incremento del volume (ΔV) per la pressione (P).
Questo tipo di lavoro è detto lavoro pressione-volume.
$$ L = P \cdot ΔV $$
Posso riscrivere l'energia interna in questa forma
$$ ΔE = Q - L $$
$$ ΔE = Q - P \cdot ΔV $$
In questo esempio, però, il volume dei recipienti è costante (ΔV=0). Quindi, l'espansione non cede, né acquista un lavoro (L=0).
$$ ΔE = Q - 0 $$
Quando il sistema non cede, né acquista un lavoro, la variazione dell'energia interna (ΔE) coincide con la variazione del calore (calore di reazione).
$$ ΔE = Q $$
Nota. Se l'espansione del gas non varia la temperatura dell'acqua che resta costante a 20°C, non produce, né assorbe calore (Q=0). In questo caso particolare, l'energia interna del sistema resta invariata. $$ ΔE=Q - L = 0 - 0 = 0 $$
E così via.
