Composti ionici
Cosa sono i composti ionici
I composti ionici sono formati da ioni positivi e negativi (monoatomici o pluriatomici) legati tra loro dalle forze elettrostatiche.
Il legame chimico che tiene uniti gli ioni è detto legame ionico.
Esistono diversi composti ionici binari, ternari, ecc.
Nota. Un composto ionico binario è generalmente formato da un metallo e un non metallo. Il metallo cede uno o più elettroni al non metallo. Si formano così ioni positivi e negativi che si dispongono in un reticolo.
Allo stato solido i composti ionici hanno una struttura a reticolo cristallino e sono detti solidi ionici o cristalli ionici.
Nei solidi ionici gli ioni si dispongono in modo regolare nello spazio.
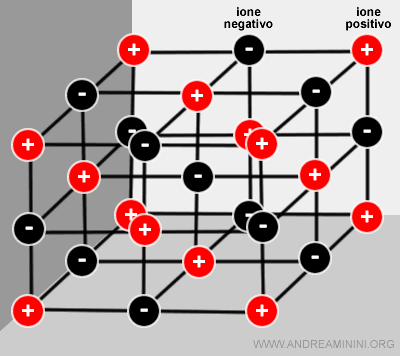
In un composto ionico non ci sono molecole discrete ma soltanto una grande quantità di ioni legati tra loro dalle forze coulombiane.
Un esempio di composto ionico
Un esempio comune di solido ionico è il cloruro di sodio (NaCl).
Il sodio (Na) cede un elettrone trasformandosi in uno ione positivo (Na+)
Il cloro (Cl) acquista un elettrone trasformandosi in uno ione negativo (Cl-).
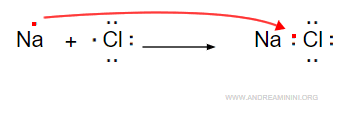
I due ioni si legano tra loro per effetto della forza elettrostatica (Na+Cl-) ossia per il legame ionico.
Non si tratta però di una molecola, perché ogni ione di sodio è circondato da 6 ioni di cloro.

Quindi NaCl è soltanto una formula minima (detta unità di formula) che indica la proporzione tra gli elementi chimici.
L'unità formula
Cos'è l'unità di formula
L'unità di formula è un gruppo di ioni coincidenti con la formula minima del composto ionico.
Esempio 1
L'unità di formula NaCl del cloruro di sodio indica che nel composto ionico per ogni atomo di sodio c'è un atomo di cloro.
Pertanto, il rapporto è 1:1:
Esempio 2
L'unità di formula MgCl2 indica che nel composto ionico c'è un atomo di magnesio per ogni due atomi di cloro.
Pertanto, il rapporto è 1:2.
Nota. Da questo deduco che il magnesio (Mg) cede due elettroni e si trasforma in uno ione positivo (Mg2+). I due elettroni sono acquisiti da due atomi di cloro (Cl2-) che si trasformano in due ioni positivi. Ci sono due atomi di cloro perché a ogni atomo di cloro manca un solo elettrone per completare l'ottetto. In conclusione, nel composto ionico MgCl2 c'è uno ione positivo di magnesio (Mg2+) per ogni due ioni negativi di cloro (Cl2-).
Il peso formula
Cos'è il peso formula
Il peso formula (o peso formale) di un composto ionico è la massa di un'unità di formula.
Per calcolare il peso formula basta sommare i pesi atomici degli elementi presenti nell'unità di formula del composto ionico.
Nota. Nel caso dei composti ionici non si può parlare di peso molecolare perché non esiste una molecola. Per questa ragione si utilizza il peso formula.
Il numero di coordinazione
Cos'è il numero di coordinazione
Il numero di coordinazione di un composto ionico è il numero di atomi direttamente adiacenti a un atomo in una struttura cristallina.
Il numero di coordinazione non può superare 12.
Esempio 1
In un reticolo cubico il numero di coordinazione è pari a 6.

Esempio 2
In un reticolo esagonale il numero di coordinazione è 12.
La valenza ionica o elettrovalenza
Cos'è la valenza ionica
La valenza ionica (o elettrovalenza) di un elemento chimico è il numero di elettroni che l'atomo cede o acquista quando si forma il composto ionico.
Esempio 1
L'idrogeno (H) ha valenza ionica pari a +1 perché può cedere un elettrone.
E' detto monovalente positivo.
Esempio 2
L'ossigeno (O) ha valenza ionica pari a -2 perché deve acquisire due elettroni per completare l'ottetto.
E' detto bivalente negativo.
Le caratteristiche dei composti ionici
I composti ionici allo stato solido (solidi ionici) sono cattivi conduttori di elettricità perché gli ioni occupano una posizione fissa nel reticolo.
I composti ionici allo stato liquido, invece, diventano buoni conduttori di elettricità.
In genere i composti ionici hanno una temperatura di fusione molto alta.
E così via.
