Il numero quantico di spin dell’elettrone
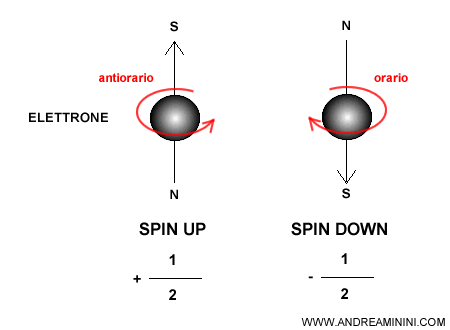
Il numero quantico di spin è il quarto numero quantico necessario per descrivere lo stato di un elettrone in un atomo, accanto a $n$, $l$ e $m$. Si indica con la lettera $m_s$ e può assumere soltanto due valori discreti:$$m_s = +\tfrac{1}{2}, \quad m_s = -\tfrac{1}{2}.$$ Questi due valori rappresentano i due possibili orientamenti dello spin, comunemente detti spin up (↑) e spin down (↓).
In un atomo ogni elettrone è associato a una quaterna di numeri quantici $n, l, m, m_s$ che ne descrivono lo stato, la sua orbita, la sua posizione, ecc. Tra questi c'è anche lo spin.
- $ n $ è il numero quantico principale e identifica il livello energetico dell'orbitale.
- $ l $ è il numero quantico secondario (o azimutale) e identifica una particolare forma dell'orbitale.
- $ m $ è è il numero quantico magnetico che indica l'orientamento dell'orbitale
- $ m_s $ è lo spin
I primi tre numeri quantici $ n, l, m $ individuano in quale orbitale si trova l'elettrone. Il quarto numero $ m_s $, invece, è lo spin che può essere Up o Down.
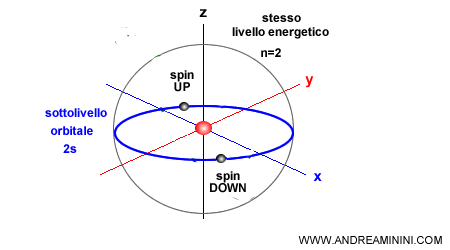
In un atomo ogni elettrone ha una quaterna di numeri quantici distinta dagli altri secondo il Principio di Pauli. Quindi, in un atomo non possono esistere due elettroni con gli stessi numeri quantici.
Ma di fatto cos'è lo spin dell'elettrone?
Lo spin dell’elettrone è un momento angolare intrinseco, indipendente dal suo moto orbitale attorno al nucleo.
Non si tratta però di una rotazione classica della particella su se stessa, come inizialmente si pensava, bensì di una proprietà puramente quantistica, che viene descritta mediante un vettore orientato lungo un asse di riferimento.
Origine storica. L’idea che l’elettrone possedesse un momento angolare intrinseco fu formulata nel 1925 dai fisici olandesi George Uhlenbeck e Samuel Goudsmit. Formularono l’ipotesi che l’elettrone ruotasse attorno al proprio asse, come la Terra, producendo effetti nello spazio circostante. Per rappresentarlo introdussero un vettore orientato lungo l’asse di rotazione, chiamando questa grandezza momento angolare intrinseco, o spin, dell’elettrone.
In seguito si comprese che non si trattava di una vera rotazione, ma di una grandezza quantistica: una proprietà intrinseca della particella senza equivalente nella fisica classica. La loro ipotesi nacque dall’esigenza di spiegare diversi fenomeni spettroscopici che la meccanica classica non riusciva a chiarire, come l’effetto Zeeman anomalo, i doppietti osservati negli spettri degli elementi alcalini e alcune peculiarità degli spettri ai raggi X. L’esistenza dello spin è stata poi confermata sperimentalmente e oggi è considerata una caratteristica fondamentale dell’elettrone, al pari della massa e della carica elettrica.
Poiché l’elettrone possiede una carica elettrica, allo spin (momento angolare intrinseco) è associato anche un momento magnetico: in questo senso l’elettrone si comporta come un minuscolo dipolo, simile a una calamita con un polo nord e un polo sud.
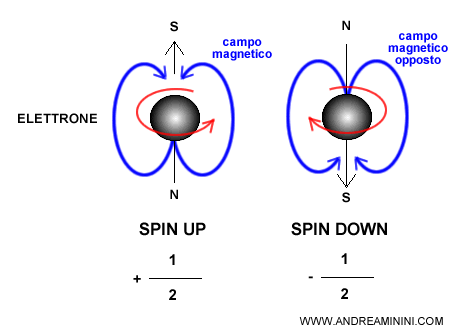
È però fondamentale distinguere le due cose: il momento angolare di spin è una grandezza meccanica, mentre il momento magnetico dell’elettrone è di natura elettromagnetica.
La quantizzazione dello spin implica che un elettrone possa trovarsi soltanto in due stati possibili:
- uno con spin positivo ($m_s = +\tfrac{1}{2}$), detto “su”
- uno con spin negativo ($m_s = -\tfrac{1}{2}$), detto “giù”
Non esistono altre possibilità intermedie.
Perché lo spin è importante?
Secondo il principio di esclusione di Pauli gli elettroni non possono avere la stessa quaterna di numeri quantici.
Come già detto, i primi tre numeri quantici $ n, l, m $ individuano in quale orbitale si trova l'elettrone.
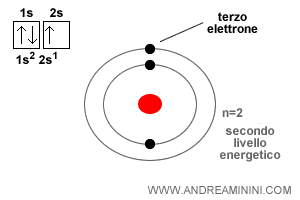
Poiché ogni orbitale può contenere fino a due elettroni, è necessario introdurre un quarto numero quantico, lo spin ( $ m_s $ ), che distingue i due casi possibili.
In questo modo, ogni elettrone è identificato da una propria quaterna di numeri quantici ( $n, l, m, m_s$ ).
Di conseguenza, in un orbitale possono coesistere al massimo due elettroni, purché abbiano spin opposto.
Per questo motivo, in genere un orbitale viene rappresentato con un quadratino che può contenere al massimo due frecce, una orientata verso l’alto (↑) e l’altra verso il basso (↓).
Nota. La distinzione tra momento angolare orbitale e momento angolare di spin è essenziale. Il primo è legato al moto dell’elettrone attorno al nucleo e dipende dai numeri quantici $l$ e $m$; il secondo è invece una proprietà intrinseca della particella, lo spin, ed è indipendente dalla traiettoria orbitale.
E così via.
