I solidi cristallini
I solidi cristallini sono composti da particelle (atomi, ioni o molecole) disposte in modo ordinato, secondo una struttura geometrica a tre dimensioni ( detta cella elementare ) che si ripete uguale in ogni direzione senza creare spazi vuoti, formando un reticolo cristallino.
Possono essere composti da aggregati di cristalli di piccole dimensione o da un singolo cristallo.
Alcuni esempi di solidi cristallini sono i minerali, i sali e molti metalli.
I minerali sono solidi cristallini naturali formati da un singolo elemento o da un composto chimico.
Come si forma un cristallo. Il processo di cristallizzazione si verifica tramite la disposizione graduale delle particelle intorno una struttura regolare detta nucleo, secondo uno schema ordinato e ripetitivo.
Per convenzione si sceglie come cella elementare del cristallo la struttura con il volume più piccolo possibile che abbia gli angoli più vicini possibile a 90°.
La cella elementare è detta cella primitiva o semplice quando ha gli stessi elementi di simmetria del reticolo cristallino.
Le caratteristiche dei solidi cristallini
Le principali caratteristiche dei solidi cristallini sono le seguenti:
- Forma geometrica dei cristalli
Un cristallo si presenta con una forma geometrica caratterizzata da superfici piane dette facce, secondo uno schema ordinato, regolare e simmetrico. Questo è dovuto al ripetersi regolare di una stessa struttura submicroscopica, detta cella elementare, nel reticolo cristallino. - Temperatura di fusione netta
I solidi cristallini hanno una temperatura di fusione netta (o punto di fusione) entro un margine di 1-2°C. Vuol dire che il passaggio di stato da solido a liquido avviene a una determinata temperatura. Questo accade perché il solido ha una struttura regolare, quindi ha le stesse proprietà in ogni punto al suo interno. Ovunque i legami chimici tra le particelle hanno la stessa energia di legame. Quando il solido è sottoposto a una determinata energia termica (calore latente di fusione), tutti i legami chimici tra le particelle del cristallo si spezzano quasi contemporaneamente.Nota. Lo stesso fenomeno si verifica nel passaggio di stato inverso da liquido a solido. Il calore rilasciato durante il processo di solidificazione è uguale al calore latente di fusione.
Altre caratteristiche relative dei cristalli
- Anisotropia e isotropia
In genere i solidi cristallini composti da un singolo cristallo sono anisotropi, ossia alcune proprietà (es. durezza, rifrazione, ecc.) cambiano a seconda della direzione. Viceversa, i solidi cristallini composti da aggregati di piccoli cristalli sono isotropi. In questo caso le proprietà sono identiche in ogni direzione, perché i cristalli sono orientati allo stesso modo in ogni direzione. - Isomorfismo e polimorfismo
In alcuni casi sostanze diverse cristallizzano allo stesso modo (isomorfismo). In altri casi, una stessa sostanza cristallizza in modo diverso (polimorfismo). - Fluorescenza e fosforescenza
Alcuni cristalli emettono radiazioni nel campo visivo, colorate, quando sono investiti da radiazioni elettromagnetiche ultraviolette. Si parla di fluorescenza se la radiazione emessa cessa con l'irraggiamento. Si parla di fosforescenza, se la radiazione emessa continua anche dopo il cessare dell'irraggiamento.
Tipi di solidi cristallini
A seconda del legame chimico posso classificare i solidi cristallini in
- Solidi cristallini ionici
Le particelle sono ioni uniti da un legame ionico. Essendo un legame chimico molto forte (alta energia di legame), è necessaria un'elevata energia per spezzarlo. Quindi, i cristalli ionici hanno un punto di fusione a temperature molto alte e sono molto duri. Sono isolanti allo stato solido e conduttori allo stato liquido. Un esempio di cristallo ionico è il cloruro di sodio (NaCl).
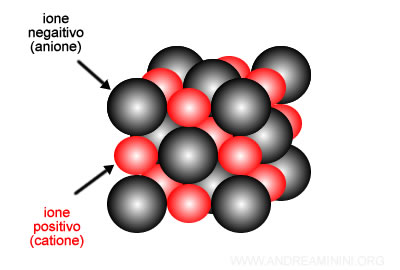
- Solidi cristallini covalenti
Le particelle sono atomi uniti da un legame covalente. Anche in questo caso l'energia di legame è molto alta. Pertanto, i cristalli covalenti hanno una temperatura di fusione molto alta, seppure inferiore a quella dei cristalli ionici. Sono duri e buoni isolanti. Un esempio di cristallo covalente è il diamante. - Solidi cristallini metallici
Le particelle sono ioni positivi circondati da un mare di elettroni, come accade in ogni metallo (legame metallico). Il legame chimico è variabile. Quindi, la temperatura di fusione dei cristalli metallici è più bassa rispetto ai cristalli ionici e covalenti. Anche la durezza è variabile. Sono buoni conduttori. Esempi di cristalli metallici sono il rame e il ferro.

- Solidi cristallini molecolari
Le particelle sono molecole o atomi, uniti tra loro da forze intermolecolari come i legami di van der Waals o i legami a idrogeno. L'energia di legame è molto bassa. Quindi, anche la temperatura di fusione dei cristalli molecolari è molto bassa. Sono fragili e buoni isolanti. Un esempio di cristallo molecolare è l'acqua H2O allo stato solido (ghiaccio) o il diossido di carbonio CO2 allo stato solido (ghiaccio secco).
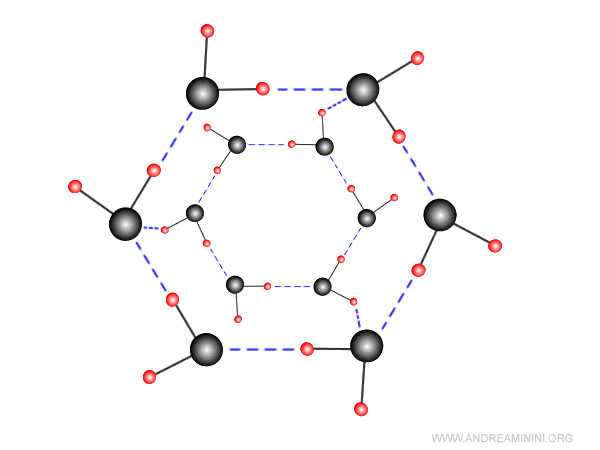
Un altro metodo di classificazione dei solidi cristallini si basa sugli elementi di simmetria del cristallo.
Il reticolo cristallino
Un reticolo cristallino è composto dalla ripetizione ordinata di una unità strutturale detta cella elementare.
Una cella elementare è composta da una struttura di particelle (ioni, atomi o molecole) disposte in un modo regolare in una particolare forma geometrica (es. cubo, parallelepipedo, tetragonale, trigonale, esagonale, ecc.) con determinati angoli e lunghezza degli spigoli (detti periodi).
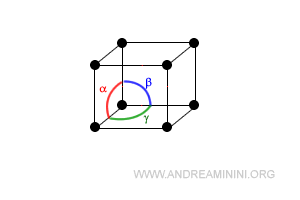
Nota. I periodi sono spigoli della cella paralleli agli assi di riferimento x,y,z. Gli angoli sono, invece, determinati prendendo due periodi coppia a coppia.
Nella cella elementare le particelle sono dei punti detti nodi reticolari.
I periodi indicano la lunghezza dei segmenti (a,b,c).
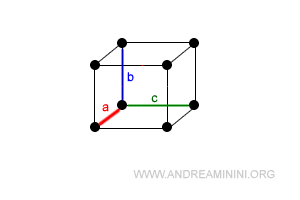
Gli angoli sono invece calcolati prendendo i periodi a coppia.
Un segmento che unisce più nodi in una direzione è anche detto filare o fila.
A loro volta, l'unione delle rette forma dei piani detti piani reticolari che caratterizzano il solido cristallino.
Nota. La disposizione dei piani reticolari forma una terna di numeri interi (hkl) detti indici, ognuno dei quali è un nodo reticolare, che permette la classificazione del solido cristallino.
La ripetizione della cella elementare in ogni direzione dello spazio compone il reticolo cristallino.
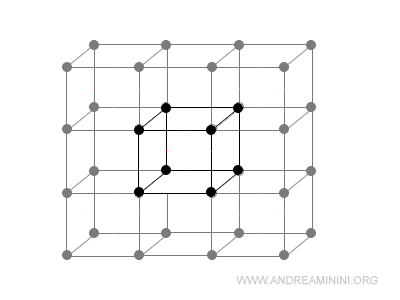
Voglio sottolineare che non tutte le strutture geometriche composte da particelle sono anche celle elementari.
E' necessario che abbiano particolari lunghezze e angoli.
Secondo la classificazione di Bravais nello spazio a tre dimensioni (x,y,z) esistono soltanto 14 tipi di celle elementari, di cui solo la metà sono fondamentali (7 sistemi cristallini) mentre le altre sono derivate dalle prime.
Queste sono le sette celle fondamentali (o primitive)
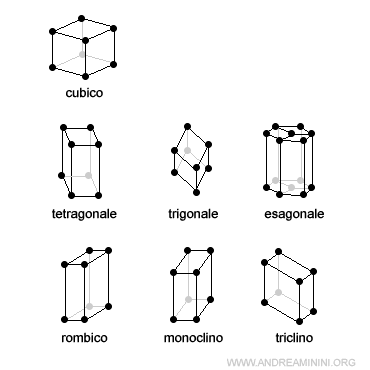
Ogni sistema cristallino è caratterizzato da particolari lunghezze dei periodi (a,b,c) e angoli (α,β,γ) dette costanti cristallografiche.
| sistema | periodi | angoli |
|---|---|---|
| cubico | a=b=c | α=β=γ=90° |
| tetragonale | a=b≠c | α=β=γ=90° |
| trigonale (romboedrico) | a=b≠c | α=β=γ≠90° |
| esagonale | a=b≠c | α=β=90° γ=120° |
| rombico | a≠b≠c | α=β=γ=90° |
| monoclino | a≠b≠c | α=β=90° γ≠90° |
| triclino | a≠b≠c | α≠β≠γ≠90° |
Nota. I sistemi in cui i periodi sono uguali a=b=c appartengono al gruppo monometrico. Quelli in cui i periodi a=b sono uguale mentre il periodo c è diverso appartengono al gruppo dimetrico. Infine, i sistemi in cui periodi sono tutti diversi a≠b≠c appartengono al gruppo trimetrico.
I tipi di celle non primitive (derivate dalle fondamentali) usate per descrivere i cristalli sono di tre tipi
- a corpo centrato (body centered cell)
- a basi centrate (base centered cell)
- a facce centrate (face centered cell)
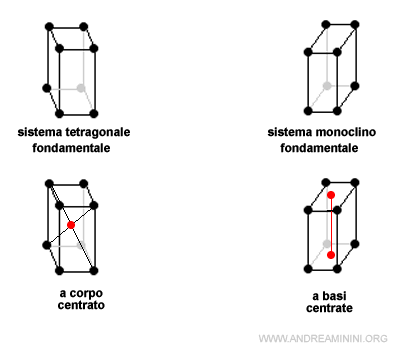
Ad esempio, la cella fondamentale del sistema rombico ha altre tre varianti derivate
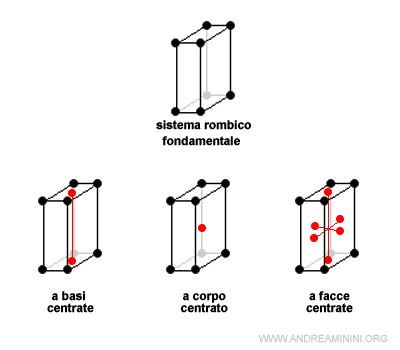
Il sistema cubico, invece, ha solo due celle derivate perché in questo caso le celle a basi centrate e a facce centrate sono uguali.
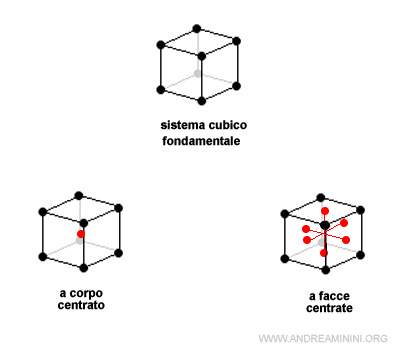
Infine, il sistema tetragonale e monoclino hanno una sola variante rispettivamente a corpo centrato e a basi centrate.
Quindi, complessivamente ci sono 7 celle fondamentali e 7 celle derivate.
A loro volta, ogni sistema cristallino è suddiviso in 32 classi caratterizzate da diversi elementi di simmetria.
Nota. La classificazione di Bravais venne confermata dagli studi sperimentali del tedesco M. von Laue e dell'inglese W.H. Bragg (e di suo figlio W.L. Bragg) all'inizio del XX secolo tramite i raggi X. Quando i raggi X colpiscono il cristallo, avendo una lunghezza d'onda simile alle distanze tra gli atomi di un sistema cristallino (circa 10-10metri), possono "fotografare" la disposizione degli atomi su una lastra sfruttando il fenomeno della diffrazione. Sulle lastre gli atomi appaiono effettivamente come punti disposti in modo regolare e simmetrico.
Gli elementi di simmetria
- I cristalli sono classificati anche in base agli elementi di simmetria delle particelle. I principali elementi di simmetria di un cristallo sono
- i centri di simmetria
- i piani di simmetria
- gli assi di rotazione
L'insieme di questi tre elementi determina il grado di simmetria (o ordine di simmetria) di un cristallo.
Il grado di simmetria è un metodo usato per classificare e identificare i minerali che si presentano in uno stato cristallino.
I centri di simmetria
Il centro di simmetria è un punto ideale all'interno del solido che divide a metà tutti i segmenti provenienti da vertici opposti, da facce opposti e da spigoli opposti del cristallo.
Ad esempio, il cubo è una cella elementare di un cristallo.
Il centro di simmetria del cubo è il punto C.
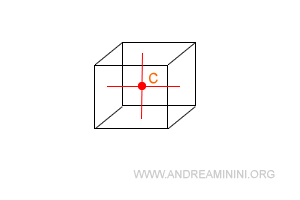
I piani di simmetria
Il piano di simmetria è un piano che divide in due parti uguali e speculari il solido cristallino.
Ecco due piani di simmetria del cubo
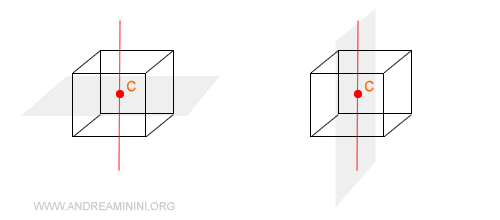
Gli assi di simmetria (o rotazione)
Un asse di simmetria è una retta intorno alla quale il solido cristallino può compiere una rotazione di 360°.
Gli assi di simmetria o rotazione sono un altro elemento di simmetria.
Ad esempio, ecco un asse di rotazione del cubo.
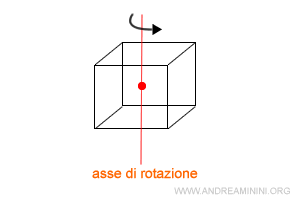
L'ordine degli assi di rotazione è misurato da un numero n che identifica un angolo (360/n)° tale che la rotazione attorno all'asse permette al solido cristallino di tornare alla posizione di origine.
Esempio. In un cubo l'ordine dell'asse di simmetria è n=4 perché una rotazione di 90° (ossia 360/4) del cubo intorno all'asse passante per il centro del cubo permette al solido di tornare alla posizione iniziale.
La differenza tra anisotropia e isotropia
Se le proprietà di un solido sono influenzate dalla direzione si parla di anisotropia. Viceversa, se non lo sono, di isotropia.
Molte proprietà dei solidi (es. durezza, conducibilità, indice di rifrazione, resistenza alla rottura, ecc. ) possono essere direzionali, ossia cambiano a seconda della direzione.
I solidi cristallini composti da singoli cristalli sono anisotropi.
Viceversa, i solidi cristallini composti da aggregati di cristalli più piccoli sono isotropi, perché i cristalli sono orientati in tutte le direzioni.
Pertanto, un solido cristallino può essere anisotropo o isotropo
Qual è la causa dell'isotropia e anisotropia?
L'isotropia e l'anisotropia di un solido dipendono dal tipo di legame chimico tra le particelle.
- Le cause dell'isotropia
I solidi con struttura ordinata (solidi cristallini) sono isotropi se il legame chimico che tiene unite le particelle è un legame ionico o un legame metallico. Il legame ionico dipende dalle forze elettrostatiche tra due ioni mentre il legame metallico dalle forze elettrostatiche tra i nuclei atomici positivi e un mare di elettroni negativi che li circonda. Un campo elettrico si propaga in forma radiale in tutte le direzioni. Quindi, è uguale in ogni direzione e non influenza le proprietà del solido. - Le cause dell'anisotropia
I solidi con struttura ordinata (solidi cristallini) sono anisotropi se il legame chimico che tiene unite le particelle è un legame covalente o intermolecolare. Nel legame covalente gli atomi si dispongono in particolari geometrie. Anche nei legami intermolecolari (dipolo-dipolo, a idrogeno, forze di van der waals) le molecole si dispongono in particolari geometrie. In questi casi la direzione influisce sulle proprietà dei solidi.
Difetti reticolari nei cristalli
I reticoli cristallini non sono perfetti, spesso presentano dei difetti reticolari che alterano le proprietà del cristallo ideale.
E' quasi impossibile trovare un cristallo perfetto. Più o meno ci sarà sempre qualche difetto.
I principali difetti sono di tre tipi:
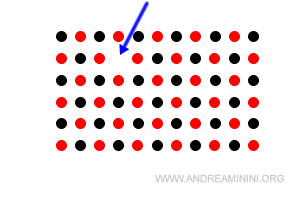
- Lacune reticolari (o vacanze reticolari)
Alcuni nodi (ioni o atomi) del reticolo sono mancanti. Sono vuote. Questi difetti sono anche detti difetti di Schottky.
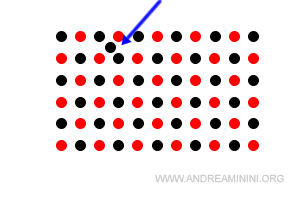
- Lacune interstiziali
Alcune particelle si collocano in una posizione intermedia tra due nodi. Questi difetti sono anche detti difetti di Frenkel.
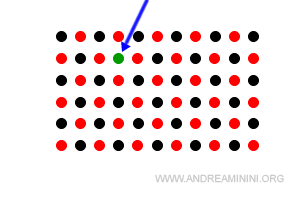
- Sostanze estranee nel reticolo
Un altro tipo di difetto è la presenza di altre sostanze estranee nel reticolo, diverse dalle specie chimiche che compongono il solido cristallino.
I difetti reticolari possono essere più o meno mobili, a seconda della mobilità delle particelle nel reticolo.
Quando i difetti nel reticolo sono molto marcati i cristalli sono detti solidi difettivi.
La presenza dei difetti nel reticolo può modificare in modo sensibile la conducibilità del solido.
Nota. La presenza dei difetti reticolari è alla base dei semiconduttori drogati. Sono realizzati rimuovendo o introducendo volontariamente un determinato numero di impurità nel reticolo, per modificare la conducibilità del solido cristallino. Ad esempio, il germanio è un solido cristallino covalente che conduce male la corrente elettrica. Se inserisco nel reticolo del germanio una determinata quantità di arsenico, il solido cristallino diventa un buon conduttore anche a temperatura ambiente, perché l'atomo di arsenico introduce nel reticolo un elettrone di valenza in più che può muoversi liberamente.
E così via.
