Solidi covalenti
I solidi covalenti sono solidi cristallini composti da atomi legati tra loro tramite legami covalenti.
Gli atomi non formano un'unità discreta (molecola singola), bensì sono tutti legati tra loro secondo uno schema regolare, ordinato e ripetuto in un reticolo cristallino.
Un cristallo è come una grande molecola.
Esempio. Sono solidi covalenti il diamante, la grafite, il biossido di silicio (SiO2) detto silice o quarzo dove la formula non indica una molecola ma il rapporto tra gli atomi Si e O presenti nel reticolo cristallino.
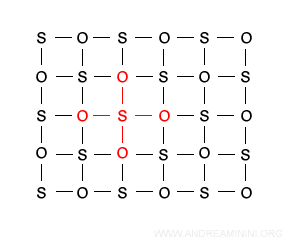
La configurazione del silicio è 3s2 3p2 mentre quella dell'ossigeno 2s2 2p4. Quindi, al silicio mancano 4 elettroni mentre all'ossigeno solo due elettroni. Nel reticolo ogni atomo di silicio forma quattro legami covalenti con quattro atomi di ossigeno.
Le caratteristiche dei solidi covalenti
Le principali caratteristiche dei solidi covalenti sono
- durezza
- temperatura di fusione molto alta (>2500°C)
Nota. Queste caratteristiche sono dovute all'elevata forza del legame covalente. Per questa ragione l'energia reticolare di un solido covalente è molto alta. Occorre una grande quantità di energia per spezzare i legami chimici tra gli atomi.
- Isolanti
Normalmente i solidi covalenti sono buoni isolanti perché gli elettroni sono impegnati nei legami covalenti. Quindi, non sono mobili e non possono muoversi nel reticolo per trasportare elettricità.Nota. Ci sono comunque alcune eccezioni di solidi covalenti con conducibilità elevato, a seconda della tipologia del legame chimico. Ad esempio, la grafite è un conduttore.
In ogni caso, le caratteristiche dei solidi covalenti dipendono dal tipo di legame covalente che può essere polare o meno.
Un esempio pratico
Il diamante e la grafite sono allotropi del carbonio. Quindi dovrebbero essere simili. In realtà, il legame covalente è diverso.
Nel diamante il legame covalente è formato dalla sovrapposizione di orbitali ibridi del tipo sp3 mentre nella grafite sono del tipo sp2.
Questa differenza determina proprietà molto diverse tra i due solidi covalenti.
Ad esempio il diamante è duro e cattivo conduttore, la grafite è invece un solido tenero e buon conduttore di elettricità.
E così via.
