Solidi metallici
I solidi metallici sono solidi cristallini a legami non direzionali. Le forze che tengono unite le particelle sono forze di natura elettrostatica, ossia le interazioni tra cariche di segno opposto.
Sono costituiti dal nucleo di ioni positivi disposti in un reticolo e circondati da un mare di elettroni di valenza delocalizzati in tutto il solido.
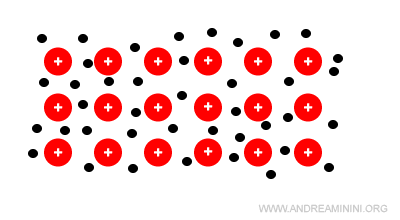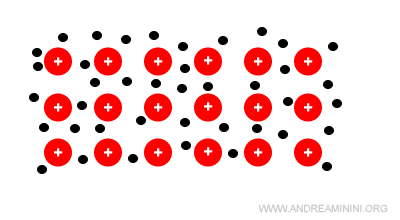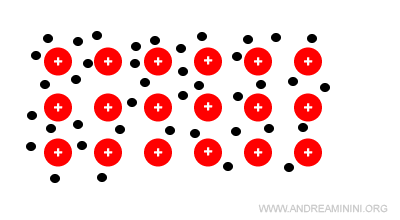
Nel legame metallico gli elettroni sono delocalizzati perché l'energia necessaria per passare dall'orbitale di un nucleo a un altro, nelle immediate vicinanze, è molto bassa.
La spiegazione
Se l'energia di ionizzazione è bassa e l'affinità elettronica per elettrone è trascurabile, gli elettroni non tendono a formare legami atomici.
In questo caso gli orbitali esterni di valenza si distribuiscono su nuovi orbitali estesi a tutto il cristallo e non appartengono più ai singoli atomi.
Quindi hanno origine orbitali molecolari estesi a tutto il cristallo.
Differenza tra solidi metallici e ionici. Nei solidi ionici l'attrazione elettrostatica si verifica tra ioni positivi e ioni negativi. Nei solidi metallici, invece, è tra ioni positivi ed elettroni delocalizzati e liberi di muoversi nel solido.
Perché il legame è non direzionale
Poiché il campo elettrico ha simmetria radiale, le interazioni si verificano allo stesso modo in ogni direzione.
Secondo la legge di Coulomb, a parità di distanza una particella attrae a sé tutte le particelle di segno opposto in qualsiasi direzione.
$$ F = - k \cdot \frac{q_1 \cdot q_2}{d^2} $$
Il segno meno davanti alla costante k permette di misurare la forza di attrazione tra le particelle di carica opposta.
Ecco perché nei metalli il legame è non direzionale.
Il reticolo cristallino dei solidi metallici
Nei solidi metallici le particelle si dispongono in modo ordinato cercando di occupare il minore spazio possibile, perché più vicine sono le particelle e maggiori sono le interazioni elettrostatiche.
Per semplicità approssimo gli atomi metallici (ioni positivi) come delle sfere.
La disposizione degli ioni positivi può avvenire in due modi:
- Disposizione esagonale
In un piano le particelle sono disposte in filari sfalsati (A). Nel piano superiore o inferiore le sfere si dispongono nelle lacune del piano precedente (B) o (C). In natura esistono due poliedri: uno basato sulla sequenza A-B-A-B (esagonale compatto) e un altro su A-B-C-A-B-C (cubico a facce centrate). Ad esempio, nel primo sistema cristallizza lo zinco, mentre nel secondo il ferro beta.
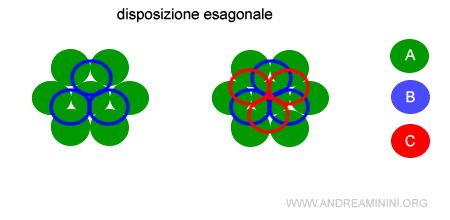
La disposizione esagonale è tipica del cromo (Cr), tungsteno (W), molibdeno (Mo). Nello spazio a tre dimensioni la struttura esagonale compatta appare in questo modo

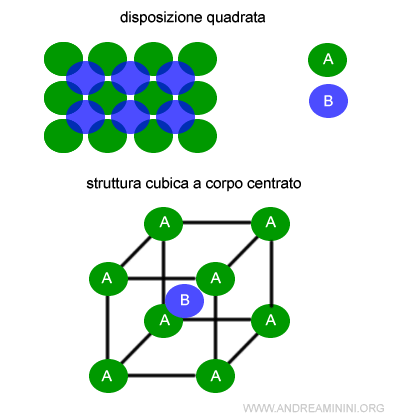
- Disposizione cubica (o quadrata espansa)
In un piano le particelle sono disposte su filari parallele sul piano, non a contatto tra di loro e con uno spazio tra l'una e l'altra. Nelle lacune si dispongono le particelle del piano immediatamente superiore e inferiore in una sequenza A-B-A-B. Nello spazio il poliedro ha una struttura cubica a corpo centrato. La disposizione cubica è tipica di rame (Cu), argento (Ag) e oro (Au)
Il numero di coordinazione
Il numero di coordinazione del reticolo è il numero di particelle immediatamente vicine ed equidistanti a una particella con cui interagisce contemporaneamente.
A cosa serve il numero di coordinazione?
Quanto più alto è il numero di coordinazione, tanto più è stabile la struttura del solido cristallino perché intorno a ogni particella ci sono più particelle, quindi le forze elettrostatiche che tengono unite le particelle nel reticolo sono maggiori.
Esempio
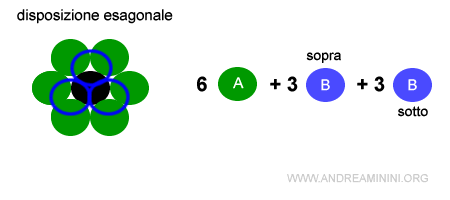
Nella struttura esagonale compatta A-B il numero di coordinazione è 6+3+3=12 ossia 6 A sul piano, 3 B sul piano superiore e 3 B sul piano inferiore.
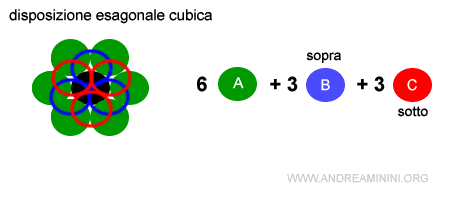
Nella struttura cubica a facce centrate A-B-C il numero di coordinazione è sempre 6+3+3=12. L'unica cosa che cambia è la disposizione 6A + 3B (sopra) + 3C (sotto).
Nel caso della struttura cubica a corpo centrato il numero di disposizione è 4+4=8.
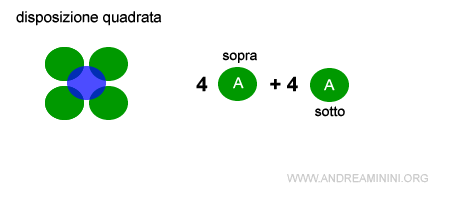
Pertanto, la disposizione quadrata espansa è meno stabile della disposizione esagonale, perché il numero di coordinazione è più basso, quindi la forza elettrostatica che tiene unite le particelle nel reticolo è inferiore.
Le caratteristiche dei solidi metallici.
Queste sono le principali caratteristiche dei metalli e la loro spiegazione chimico-fisica.
- La durezza
I cationi sono fissi in determinate posizioni reticolari. La repulsione tra gli ioni positivi è ostacolata dalla presenza degli elettroni delocalizzati che si frappongono tra un catione e l'altro. Questa caratteristica rende il metallo molto forte. - I punti di fusione variabili
Il punto di fusione è molto variabile da un metallo all'altro perché i metalli hanno diverse energie di legame. Si va da -38,9°C del mercurio (Hg) ai 3380°C del tungsteno (W). Quanto più alta è l'energia di legame del reticolo, tanto più alta è la temperatura del punto di fusione (passaggio di stato da solido a liquido). - La brillantezza e la lucentezza
Le differenze tra i livelli energetici degli atomi consentono o meno l'assorbimento dei fotoni. Quando non lo consentono, i fotoni incidenti sono emessi dal metallo verso l'esterno. - La conducibilità termica ed elettrica
La nuvola elettronica che circonda il cristallo favorisce la conducibilità termica ed elettrica del metallo, perché gli elettroni sono liberi di muoversi da una zona all'altra del cristallo. Il calore aumenta l'energia cinetica degli elettroni. Quando un elettrone è sollecitato da una carica di energia, può muoversi nella banda di valenza. Se la banda di valenza è piena può passare alla banda di conduzione adiacente o sovrapposta. - La malleabilità e la duttilità
Durante la lavorazione i metalli sono duttili e malleabili perché possono subire una deformazione senza troppe variazioni alla loro struttura reticolare. Non essendoci legami direzionali, i solidi metallici possono subire deformazioni e alterazioni della struttura cristallina in ogni direzione. Generalmente i metalli con disposizione cubica (es. rame) sono più lavorabili di quelli a disposizione esagonale (es. cromo) che, invece, sono più duri e più fragili.Nota. Nei metalli con un reticolo cubico i cationi sono disposti in piani che possono scorrere l'uno sull'altro. Nei metalli con reticolo esagonale, invece, i cationi sono disposti in filari sfalsati che ostacolano lo scorrimento dei piani e sono più vicini tra loro, quindi l'energia di legame è più forte.
La conducibilità elettrica
A mio avviso la conducibilità elettrica merita un approfondimento a parte.
Un campo elettrico carica gli elettroni del solido metallico e li spinge a muoversi nel reticolo cristallino da una zona di bassa energia potenziale verso un'altra zona con energia potenziale più alta.
Il movimento degli elettroni di conduzione nel reticolo può essere ostacolato da due aspetti
- dal tipo di disposizione reticolare dei cationi
- dalle vibrazioni termiche dei cationi.
Da questo deriva il maggiore o minore grado di conducibilità o resistenza elettrica dei metalli.
Nota. La conducibilità e la resistenza sono due aspetti dello stesso fenomeno da punti di vista diversi. La conducibilità è la capacità di far passare la corrente elettrica. La resistenza è la capacità di NON far passare la corrente elettrica.
La relazione tra conducibilità elettrica e temperatura
La conducibilità elettrica si riduce con l'aumento della temperatura.
Il calore aumenta le vibrazioni termiche degli ioni positivi intorno alla loro posizione nel reticolo cristallino.
A loro volta, le vibrazioni degli ioni positivi aumentano la probabilità di interazione tra gli elettroni e gli ioni positivi.
Questo ostacola il movimento degli elettroni di conduzione da una zona all'altra del reticolo cristallino.
Pertanto, la temperatura aumenta la resistenza elettrica.
Nota. Nei metalli ideali gli ioni positivi non interagiscono con gli elettroni. Questa situazione si verifica soltanto se la temperatura è allo zero assoluto (T=0 K), quando le vibrazioni dei nuclei atomici intorno alla loro posizione cessano del tutto. I metalli ideali sono però soltanto una semplificazione teorica. In condizioni ambientali di temperatura (T=273,15 K=0°C) tutti i cristalli sono metalli reali che ammettono in vari gradi sia le vibrazioni degli atomi che le interazioni tra elettroni e cationi.
E così via.
