I solidi ionici
I solidi ionici sono reticoli cristallini composti da ioni di carica opposta uniti tra loro dalla forza elettrostatica dei legami ionici.
Le particelle ioniche che compongono il reticolo di un solido ionico sono due specie atomiche con elettronegatività molto differente.
Ogni ione positivo (catione) è circondato da ioni negativi (anioni) e viceversa.
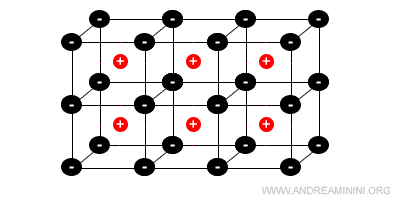
Il numero degli ioni vicini di carica opposta dipende dalle dimensioni relative del catione e dell'anione.
Nota. I solidi ionici sono classificati nei solidi cristallini a legami non direzionali perché il campo elettrico è radiale, si estende allo stesso modo in ogni direzione.
All'interno del reticolo non posso individuare le molecole singole del cristallo ionico ma soltanto una cella elementare rappresentativa del rapporto tra ioni positivi e negativi che si ripete in ogni direzione.
Esempio. La formula fluoruro di calcio CaF2 non indica la molecola ma solo il rapporto tra cationi e anioni nel reticolo. In questo caso ci sono due ioni negativi di fluoro (F2) per ogni ione positivo di calcio (Ca).
Il reticolo si forma ed è stabile se la forza attrattiva tra gli ioni di carica opposta è superiore alla forza repulsiva degli ioni di uguale carica.
Come si forma un solido ionico
In genere, un solido ionico si ottiene per reazione tra un metallo (catione) e un non metallo (anione) con più alta elettronegatività.
$$ A^+B^- $$
Il cristallo ionico può essere composto anche tra ioni molecolari.
La differenza di elettronegatività non è però sufficiente alla formazione spontanea di un composto ionico, perché l'affinità elettronica è inferiore a 350 kJ/mol mentre l'energia di ionizzazione è superiore a 400 kJ/mol.
Il passaggio degli elettroni da un atomo all'altro avviene anche per la forza di attrazione elettrostatica (legge di Coulomb) tra ioni di segno opposto.
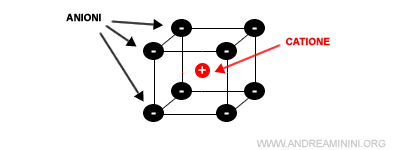
Non si formano singole coppie ioniche, perché ogni ione interagisce contemporaneamente con più ioni di segno opposto dando vita a un reticolo cristallino.
Il reticolo cristallino è complessivamente neutro.
Pertanto, un cristallo ionico può essere considerato come un'unica grande macromolecola.
Nota. Generalmente il reticolo cristallino è non direzionale perché i legami tra gli ioni sono di tipo elettrostatico. Tuttavia, potrebbero presentarsi casi di direzionalità dovuti ai legami covalenti.
Un esempio di solido ionico è il cloruro di sodio (NaCl).
Nel caso dei solidi ionici, la formula chimica indica solo il rapporto tra gli atomi degli elementi (1:1 nel caso di NaCl), non indica una molecola.
La condizione di stabilità dei solidi ionici
Nei solidi ionici si trovano contemporaneamente ioni di carica elettrica positiva (cationi) e negativa (anioni).
Quindi, tra gli ioni si verificano sia interazioni di tipo attrattivo tra ioni di carica opposta che interazioni di tipo repulsivo tra ioni con la stessa carica.
Un solido ionico si forma soltanto se le forze elettrostatiche di tipo attrattivo sono più forti delle forze di tipo repulsivo. $$ F_a > F_r $$
Quando il requisito di stabilità è soddisfatto, il reticolo cristallino ha una struttura stabile. Viceversa è instabile e si disgrega.
La disposizione delle particelle nel solido ionico deve rispettare questa semplice regola.
Nota. Secondo la legge di Coulomb la forza elettrostatica attrattiva e repulsiva sono determinate dal rapporto tra le cariche elettriche delle particelle q1 e q2 con il quadrato della distanza. Quello che cambia è solo il segno iniziale. Nella formula della forza attrattiva c'è il segno negativo. $$ F_a = -k \frac{q_1 \cdot q_2}{d^2} $$ $$ F_r = k \frac{q_1 \cdot q_2}{d^2} $$
In un solido ionico elettricamente neutro, le cariche negative e positive si eguagliano. In questi casi, il requisito di stabilità è determinato dalla distanza relativa tra le cariche elettriche di segno opposto e di segno uguale.
Le distanze tra cariche di segno opposto devono essere inferiore alle distanze tra cariche di segno uguale.
In questo caso la forza di attrazione è superiore alla forza repulsiva.
Il reticolo cristallino di un solido ionico
In generale un solido ionico cristallizza nel più alto numero di coordinazione più possibile che soddisfa il criterio di stabilità del reticolo.
Dove il numero di coordinazione è il numero di particelle vicine con cui interagisce una particella del reticolo.
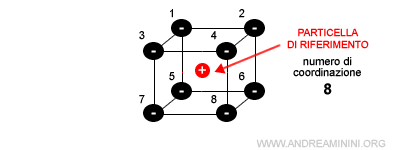
Poiché esistono diverse disposizioni reticolari stabili possibili, tra due geometrie stabili possibili si verifica quella con numero di coordinazione più alto.
Come si rappresenta il reticolo cristallino del solido ionico
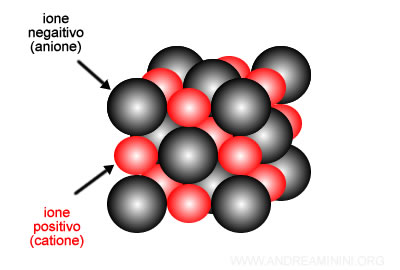
Per semplicità rappresento il reticolo cristallino usando il metodo delle sfere, dove ogni sfera approssima la dimensione di un atomo dal nucleo all'orbitale più esterno.
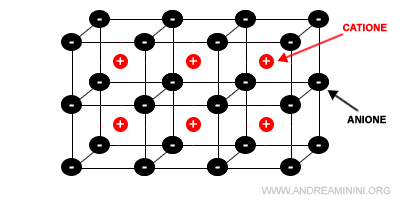
A differenza dei solidi metallici, in questo caso devo considerare due sfere di diverse dimensioni.
- Sfere più grandi per gli anioni
- Sfere più piccole per i cationi
Perché gli anioni sono più grandi dei cationi
Generalmente, gli ioni di carica negativi (anioni) sono più grandi degli ioni di carica positivi (cationi) per due motivi
- Il catione ha meno elettroni di valenza mentre l'anione ne ha di più, a parità di protoni e neutroni.
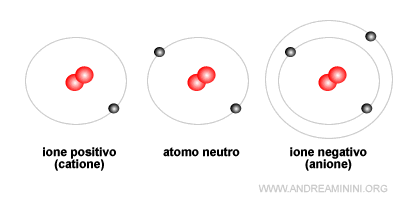
- L'orbitale più esterno di un catione ha un raggio minore rispetto all'anione perché nel catione la carica positiva del nucleo prevale sulla carica negativa degli elettroni, avvicinandoli al nucleo. Pertanto, la nuvola elettronica si contrae. Viceversa, negli anioni è maggiore la forza repulsiva tra gli elettroni.
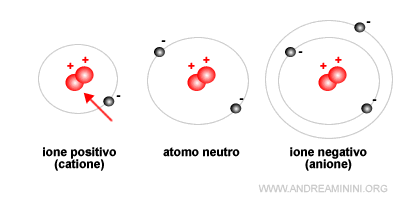
Nota. Nel 99% dei casi gli anioni sono più grandi degli anioni. Soltanto in rari casi i cationi di un elemento pesante sono più grandi degli anioni di un elemento leggero.
Caso 1
Una disposizione tipica degli ioni nel reticolo cristallino di un solido ionico è la seguente:
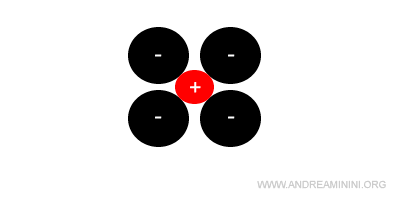
In questa semplice geometria i cationi (rossi) sono a contatto diretto con gli anioni (neri) mentre gli ioni di carica opposta (cationi-cationi e anioni-anioni) sono staccati tra di loro a una distanza finita.
Pertanto, il requisito di stabilità è soddisfatto.
Questra struttura è cubica a corpo centrato e ha numero di coordinazione pari a 8 con il catione al centro del corpo.
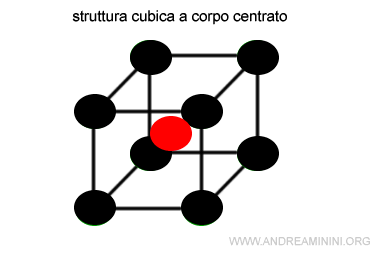
In questo caso il raggio del catione (rc) è inferiore al raggio dell'anione (ra).
$$ r_c < r_a $$
Quindi, il rapporto tra il raggio del catione (rc) e dell'anione (ra) è inferiore a 1
$$ \frac{r_c}{r_a} <1 $$
La condizione rc/ra<1 non è però sufficiente a garantire la stabilità del reticolo perché quando è troppo basso gli anioni si avvicinano oltremodo e le forze elettrostatiche repulsive prevalgono sulle forze attrattive.
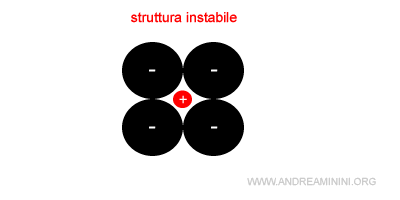
In particolar modo se il rapporto rc/ra<0,73 la struttura cristallina diventa instabile.
Caso 2
Quando il rapporto tra raggio del catione e dell'anione è inferiore a 0,73 gli ioni si dispongono in questo modo:
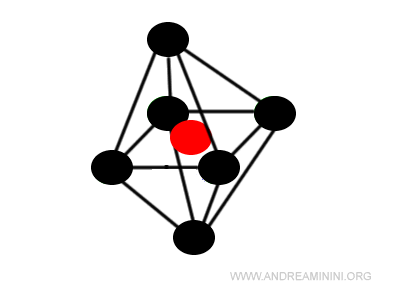
Si tratta di una struttura cristallina ottaedrica con numero di coordinazione pari a 6.
In questo caso specifico è la struttura stabile con numero di coordinazione più alto possibile.
Nota. Quando il rapporto dei raggi rc/ra è inferiore a 0,73 le strutture con numero di coordinazione pari a 8 o 12 non soddisfano la condizione di stabilità.
Questa struttura è stabile fino al limite minimo del rapporto rc/ra=0,41.
Quindi la geometria ottaedrica è stabile quando il rapporto è compreso tra 0,73>rc/ra>0,41.
Caso 3
Quando il rapporto tra il raggio del catione e dell'anione è inferiore a 0,41 il solido ionico cristallizza in una struttura tetraedrica con numero di coordinazione uguale a 4.
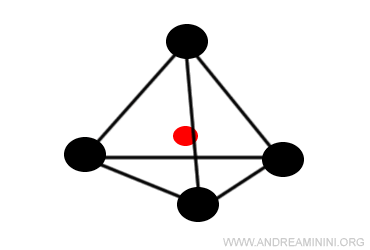
E' la struttura stabile con numero di coordinazione più alto.
La struttura è stabile per valori del rapporto compresi tra 0,22<rc/ra<0,41.
Al di sotto di rc/ra=0,22 non soddisfa il requisito di stabilità.
Caso 4
Quando il rapporto tra il raggio del catione e dell'anione è inferiore a 0,22 il solido ionico cristallizza in una struttura triangolare con numero di coordinazione uguale a 3.
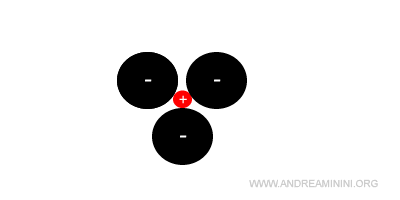
La struttura è stabile per valori del rapporto compresi tra 0,15<rc/ra<0,22.
Al di sotto di rc/ra=0,15 non soddisfa più la condizione di stabilità.
Caso 5
Al di sotto del rapporto rc/ra<0,15 il solido ionico potrebbe cristallizzare in una struttura lineare con numero di coordinazione uguale a 2.
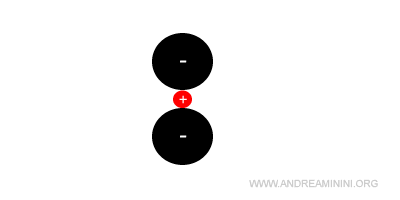
Tuttavia, questa struttura è puramente teorica perché non esiste in natura.
Caso 6
Un altro caso teorico si verifica quando il raggio del catione e dell'anione sono uguali.
$$ r_c = r_a $$
Si tratta di un caso puramente teorico perché non esiste nessun catione con raggio uguale all'anione.
In questo caso teorico l'unica geometria stabile è del tipo esagonale compatto o cubico a facce centrate.
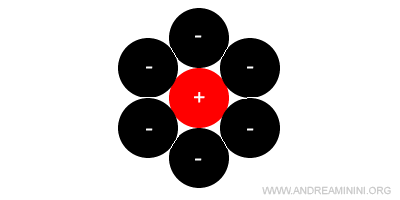
Questa struttura reticolare ha un numero di coordinazione pari a 12 perché il catione è circondato da dodici anioni.
Sono 6 anioni sul piano, 3 anioni sul piano superiore e 3 anioni sul piano inferiore.
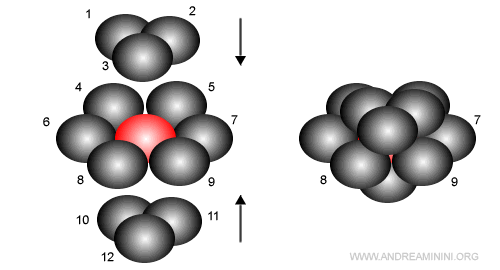
Nota. Il numero di coordinazione 12 è il più alto possibile in natura. Non esistono strutture reticolari con numero di coordinazione più alto.
Le caratteristiche dei solidi ionici
Ecco le principali caratteristiche di un solido ionico
- Durezza
- Fragilità
- Temperatura di fusione molto alta (300-1100°C)
Nota. Queste prime tre caratteristiche dipendono dal legame ionico che tiene uniti gli ioni. Il legame ionico è un legame chimico molto forte e l'energia reticolare del cristallo è migliaia di joule per mole (kJ/mol).
- Cattivi conduttori
I solidi ionici sono cattivi conduttori perché gli ioni sono fissi in una posizione e non possono trasportare. Tuttavia, diventano buoni conduttori allo stato solido.Nota. Quando un solido ionico fonde, passa allo stato liquido e le specie ioniche possono spostarsi per effetto di un campo elettrico. Viceversa, allo stato solido le specie ioniche sono in una posizione fissa del reticolo.
- Solubili
Nota. I solidi ionici sono solventi polari. Quando sono a contatto con l'acqua, o più in generale di un solvente, gli ioni del cristallo si orientano verso il polo di carica opposta delle molecole del solvente (solvatazione), separandosi dal reticolo cristallino.
E così via.
