I solidi molecolari
I solidi molecolari sono reticoli cristallini composti da molecole legate tra loro da forze intermolecolari di natura elettrostatica (legami dipolari, legami a idrogeno, legami di van der Waals).
Si tratta di interazioni molto deboli tra le particelle e di varia natura.
Quindi, l'energia reticolare del solido molecolare è bassa, solo poche decine di kJ/mol.
Nota. Il legame a idrogeno ha un'energia media di 8-33 kJ/mol mentre le interazioni dipolari solo 1-5 kJ/mol. In ogni caso le forze intermolecolari elettrostatiche sono più basse rispetto ai legami covalenti (intramolecolari) che hanno un'energia media di 60-100 kJ/mol. Per un confronto, l'energia reticolare è simile all'energia necessaria per trasformare una mole di solido in gas (energia di sublimazione).
I solidi molecolari appartengono alla classe dei solidi cristallini, in quanto sono caratterizzati da un reticolo ordinato.
In genere sono composti da elementi che in condizioni ambientali di temperatura e pressione si trovano allo stato aeriforme.
Come si forma un solido molecolare
I legami chimici che danno origine a un solido molecolari sono molto deboli.
Si tratta di interazioni intermolecolari di natura elettrostatica.
Esempio. Le interazioni intermolecolari di natura elettrostatica sono notevolmente più basse rispetto alle interazioni intramolecolari che danno origine ai legami covalenti. Per far evaporare una mole d'acqua liquida occorre una quantità di energia pari a E=41 kJ/mol. Per spezzare un legame covalente O-H, invece, è necessaria una quantità di energia molto più alta, circa E=930 kJ/mol.
Quindi, per raggiungere un'attrazione sufficiente alla formazione del reticolo cristallino è necessaria una maggiore aderenza tra le particelle.
In genere, la geometria del cristallo rispecchia la simmetria delle singole molecole che lo compongono.
Esistono in natura numerose forme del reticolo cristallino di un solido molecolare, perché la disposizione dei siti nello spazio varia a seconda delle caratteristiche delle molecole.
Esempi di solidi molecolari
Esempio 1
Un esempio di solido molecolare è l'acqua (H2O) allo stato solido.
Una molecola d'acqua ha angoli di legame H-O-H di 104° ed è una molecola polare.
Perché è una molecola polare? Le piccole dimensioni dell'atomo di idrogeno (H) e la presenza di un solo elettrone, rendono particolarmente intenso il campo elettrico di carica positiva intorno agli atomi di idrogeno. Quindi, i legami elettrostatici che si formano hanno una discreta energia (20 kJ/mol). In particolar modo, l'atomo di idrogeno forma un legame elettrostatico con un altro atomo fortemente elettronegativo (es. ossigeno, fluoro ecc.) di un'altra molecole. Tale legame è detto legame e idrogeno.
Tra i poli delle molecole si instaurano dei legami O-H di natura elettrostatica detti legami a idrogeno.
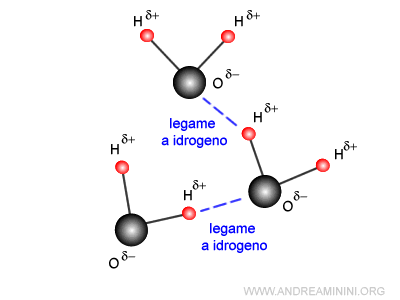
Quando la temperatura si abbassa, l'energia cinetica delle molecole si riduce, permettendo la formazione di un maggior numero di legami di idrogeno.
Pertanto, l'acqua liquida cristallizza in ghiaccio solido.
Nel processo di solidificazione le molecole d'acqua si dispongono nello spazio secondo una particolare geometria che riflette la loro polarità per massimizzare il numero di legami a idrogeno.
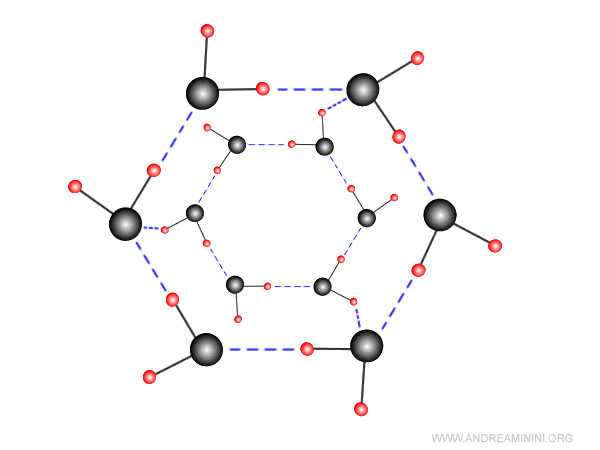
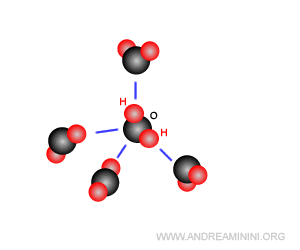
Ogni molecola d'acqua può formare quattro legami a idrogeno, due con l'atomo di ossigeno e altri due con i due atomi atomi di idrogeno.
Alla temperatura T=0°C ogni molecola ha quattro legami a idrogeno.
In questo modo si forma il reticolo cristallino tipico del ghiaccio d'acqua.
Esempio 2
Un esempio di solido molecolare è il ghiaccio secco, ossia il biossido di carbonio (CO2) allo stato solido.
La molecola CO2 ha momento dipolare nullo, quindi la struttura della molecola è lineare.
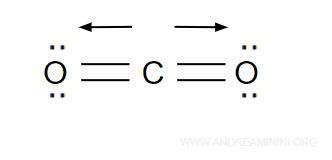
Tra le molecole della CO2 si instaurano solo deboli interazioni dipolari.
Nota. Le interazioni intermolecolari dell'anidride carbonica sono notevolmente più basse rispetto all'acqua. Per questa ragione il biossido di carbonio solidifica a una temperatura molto più bassa (-78°C) rispetto al ghiaccio dell'acqua (0°C).
Le molecole si combinano in una struttura tetraedrica con un vuoto all'interno.
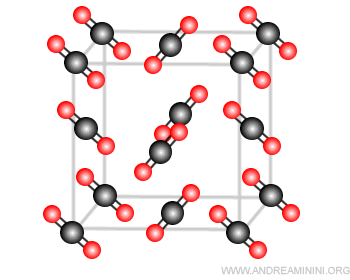
Nota. La presenza del vuoto al centro della struttura tetraedrica determina una minore densità del ghiaccio secco rispetto al ghiaccio d'acqua.
Le caratteristiche dei solidi molecolari
Ecco le principali caratteristiche dei solidi molecolari:
- Scarsa durezza
Sono facilmente deformabili. - Bassa densità
Esempio. Il ghiaccio è un solido molecolare, galleggia sull'acqua perché ha una densità più bassa. La densità del ghiaccio è più bassa dell'acqua perché i legami a idrogeno allontanano le molecole tra loro per consentire la formazione di tutti i legami intermolecolari.
- Temperatura di fusione bassa
Nota. La temperatura di fusione è correlata alla simmetria delle molecole nel cristallo. Quindi, i solidi molecolari con minore simmetria hanno punti di fusione più bassi.
- Cattivi conduttori di corrente elettrica
In quanto non ci sono molti elettroni liberi per trasportare l'elettricità.
E così via.
