Le fasi in chimica
Cos'è una fase
In chimica una fase è una parte di un sistema caratterizzata dalla stessa composizione chimica e dallo stesso stato fisico, distinta dalle altre parti del sistema.
Quindi, una fase è una parte fisicamente e chimicamente omogenea del sistema.
Dove il sistema in chimica può essere una sostanza pura o un composto.
Un sistema può presentare contemporaneamente più fasi al suo interno (sistema plurifase) oppure una sola fase (sistema monofase).
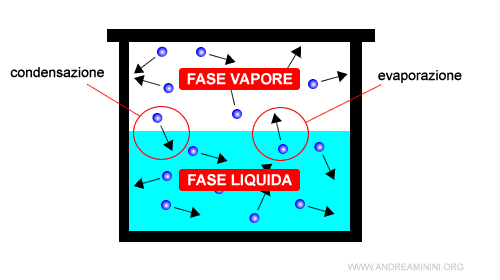
Un esempio pratico. Prendo una pentola, la riempio per metà d'acqua e la copro con un coperchio. E' un sistema chiuso. Quando la pentola è sul fuoco, all'interno si formano due fasi: una fase vapore nella parte superiore composta dalle molecole H2O(stessa composizione chimica) allo stato aeriforme (stesso stato fisico). una fase liquida nella parte inferiore composta dalle molecole H2O (stessa composizione chimica) allo stato liquido (stesso stato fisico).
Le caratteristiche della fase
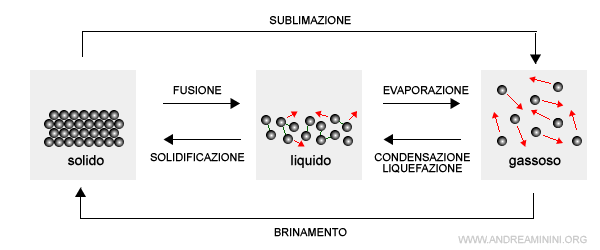
Le principali fasi della materia sono
- la fase solida
- la fase liquida
- la fase aeriforme
Sono coincidenti con gli stati fisici di aggregazione della materia.
Le principali caratteristiche delle fasi sono le seguenti:
- Una fase può essere piccola o grande.
- Si può presentare in un unico blocco (es. reticolo cristallino) o suddivisa in parti più piccole (es. singoli cristalli).
- Se un sistema ha più fasi, generalmente le fasi sono separate tra loro.
- Ogni fase ha la stessa composizione chimica (es. H2O) e lo stesso stato fisico (es. solido).
Nota. Prendendo come esempio l'acqua, le molecole H2O possono presentarsi allo stato solido, liquido o aeriforme (vapore). In alcune condizioni di temperatura e pressione le fasi coesistono tra loro. Ad esempio, a 20°C e 1 atm (760 torr) di pressione l'acqua si trova allo stato liquido ma contemporaneamente evapora a causa del passaggio allo stato aeriforme delle molecole con un moto orientato verso la superficie e sufficiente energia cinetica. Quindi, una parte delle molecole è in fase liquida e un'altra in fase aeriforme (vapore).
Il diagramma delle fasi
Il diagramma delle fasi (o diagramma di stato) è una rappresentazione grafica usata per descrivere gli stati e le fasi di una sostanza pura.
E' un diagramma cartesiano in cui si misura la temperatura della sostanza (T) sulle ascisse e la pressione (P) sulle ordinate.
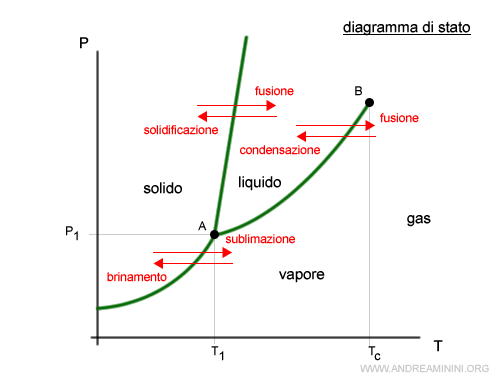
Al variare della pressione e della temperatura, la materia passa da uno stato a un altro, oppure presenta più fasi contemporaneamente.
Ogni punto del piano identifica una combinazione di temperatura (T) e pressione (P).
Nella linea che separa le regioni del diagramma di stato si verifica una condizione di equilibrio dinamico tra due distinte fasi.
Nota. In condizioni di equilibrio dinamico, il numero delle molecole che passa da una fase all'altra (es. evaporazione dalla fase liquida ad aeriforme) è uguale a quello delle molecole che passano in senso opposto (condensazione dalla fase aeriforme a liquida).
E così via.
