Gli stati fisici della materia
La materia può presentarsi in tre stati di aggregazione molecolare, detti stati fisici, che determinano il suo aspetto, il suo volume e la sua forma.
- Solido. Nello stato solido la materia ha una forma e un volume costante. La forza di coesione è elevata.
- Liquido. Nello stato liquido la materia ha un volume costante ma non ha una forma propria.
- Gassoso. Nello stato gassoso la materia è priva sia di volume che di forma propria. La forza di coesione è bassa.
Perché si chiama aggregazione molecolare? Si parla di aggregazione molecolare perché lo stato fisico dipende dalla forza di coesione tra le molecole della materia. Cos'è la forza di coesione? E' una forza di attrazione reciproca fra molecole uguali. Ad esempio, la forza di coesione tra due molecole d'acqua.
Le caratteristiche degli stati della materia
In fisica i principali stati di aggregazione molecolare della materia sono i seguenti:
- Solido
La materia solida ha una propria forma e volume costanti. Le particelle sono molto vicine tra loro con poche possibilità di movimento, perché la forza di coesione molecolare è molto forte. La struttura è rigida e cristallina. - Liquido
La materia liquida ha un proprio volume costante. Non ha forma propria. Prende la forma del recipiente che la contiene. Le particelle sono più distanziate tra loro rispetto ai solidi e la forza di coesione molecolare è più debole. Quindi, c'è maggiore possibilità di movimento. La struttura è variabile perché i legami molecolari sono deboli. - Aeriforme
La materia aeriforme è priva di forma e volume proprio. La materia occupa tutto il volume del recipiente che la contiene. Le particelle sono distanti tra loro e la forza di coesione molecolare è minima. Le molecole possono muoversi facilmente in ogni direzione. A differenza della materia solida e liquida, la materia allo stato aeriforme si comprime facilmente. La struttura è molto variabile ed è disordinata, cambia rapidamente perché la forza di attrazione molecolare è quasi assente.
Si parla di cambiamento di stato quando la materia passa da uno stato fisico a un altro.
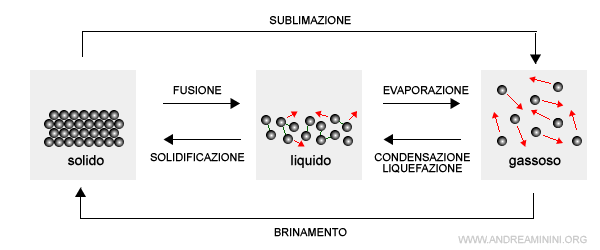
I principali passaggi di stato fisico della materia sono la fusione, la solidificazione, la liquefazione, la condensazione, l'ebollizione, l'evaporazione e la sublimazione.
Cosa determina lo stato fisico?
Lo stato di aggregazione della materia dipende dalle forze tra le particelle (es. intermolecolari).
A loro volta le forze tra le particelle sono influenzate dalle condizioni ambientali. In particolar modo, dalla temperatura e dalla pressione.
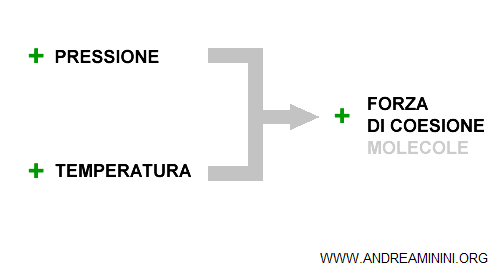
La pressione e lo stato fisico
Quando aumenta la pressione, le molecole sono spinte ad avvicinarsi tra loro. Si riduce la distanza intramolecolare ed è più forte la forza di coesione.
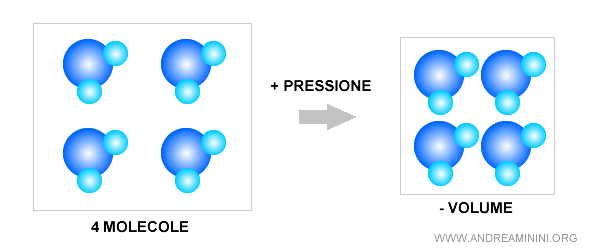
Essendo le molecole più vicine tra loro, si riduce il volume di spazio occupato dalla materia.
Esempio. Se aumenta la pressione un gas passa allo stato liquido.
Viceversa, se la pressione diminuisce, le molecole si allontanano tra loro e si riduce la forza di coesione della materia.
La temperatura e lo stato fisico
L'aumento della temperature spinge le molecole a muoversi più velocemente. In queste circostanze è più difficoltoso stabilire un legame chimico con altre molecole uguali.
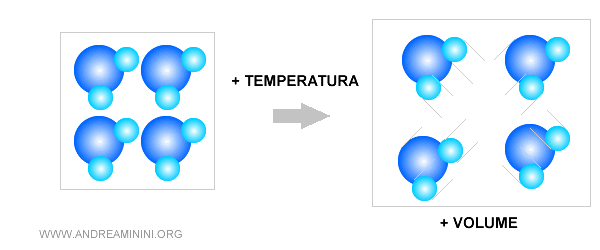
Pertanto, la forza di coesione tra le molecole è minore. Essendo più lontane tra loro, aumenta il volume di spazio occupato dalle molecole.
Esempio. Quando l'acqua viene riscaldata, il calore aumenta l'energia cinetica delle particelle. Muovendosi più velocemente, le molecole dell'acqua hanno più possibilità di vincere le forze attrattive che tengono legate le particelle tra loro (legami a idrogeno). Quindi, una parte delle molecole H2O evapora nell'aria sotto forma di vapore acqueo. Queste molecole passano dallo stato liquido a quello gassoso.
Viceversa, se la temperatura è bassa, le molecole si muovono più lentamente, si instaurano più facilmente i legami chimici con altre molecole uguali e la forza di coesioni è più forte.
Esempio. Alle basse temperature le molecole d'acqua sono così vicine da formare dei legami stabili. L'acqua passa così dallo stato liquido a quello solido e diventa ghiaccio.
I diagrammi di stato
I diagrammi di stato forniscono una rappresentazione sintetica delle condizioni in cui la materia si presenta in uno stato o in un altro.
In generale, lo stato di aggregazione di una sostanza dipende dai valori di temperatura e pressione dell'ambiente in cui si trova.
Ogni sostanza pura è caratterizzata da un proprio diagramma di stato ( o diagramma di fase).
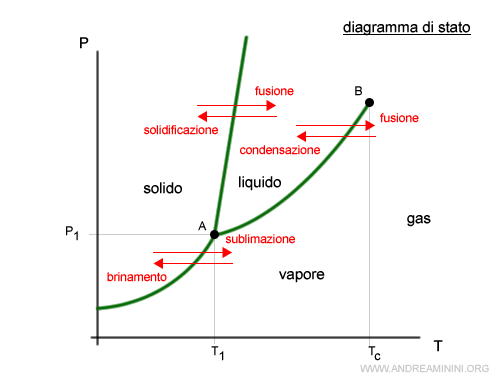
Nelle zone di confine tra uno stato e l'altro (linea verde) si verificano una situazione di equilibrio dinamico tra due fasi in cui il flusso da uno stato a un altro è uguale al flusso opposto.
Esempio. Nella linea che separa lo stato liquido da quello aeriforme, la quantità di particelle che passano dallo stato liquido a quello aeriforme (evaporazione) è uguale alla quantità di particelle che passano dallo stato aeriforme allo stato liquido (condensazione).
Dove per fase intendo una parte della sostanza caratterizzata dalla stessa composizione chimica e stato fisico, separata dalle altri parti (fasi) della sostanza.
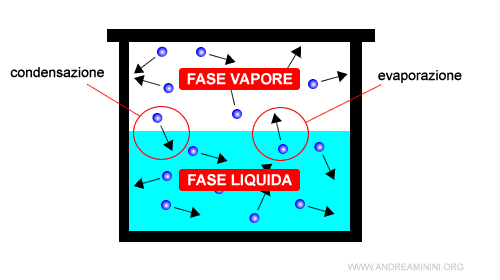
E così via.
