Principio di Le Chatelier
Se un sistema in equilibrio è sottoposto a una sollecitazione esterna, il sistema reagisce per contrastare o annullare l'effetto della sollecitazione.
Il principio di Le Chatelier è anche detto principio dell'equilibrio mobile.
Il sistema reagisce alla sollecitazione esterna per raggiungere un nuovo equilibrio dinamico, se possibile.
Un esempio pratico
Prendo in considerazione un sistema in equilibrio dinamico tra le fasi liquido-vapore in un recipiente chiuso a temperatura costante.
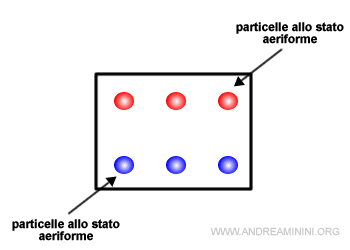
Nota. In equilibrio dinamico la quantità di molecole che passa da liquido a vapore (evaporazione) è uguale a quella che passa da vapore a liquido (condensazione).
A questo punto riduco il volume del recpiente ( sollecitazione esterna ).
Il minore volume del recipiente causa un aumento della pressione interna del sistema ( effetto della sollecitazione ).
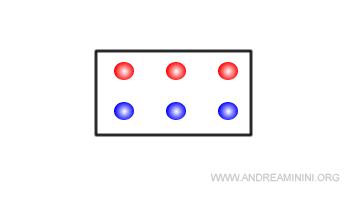
Per reagire all'aumento della pressione interna, il sistema reagisce spontaneamente aumentando la quantità di molecole allo stato liquido ( reazione del sistema ), perché allo stato liquido la materia occupa meno spazio (volume) rispetto allo stato aeriforme.
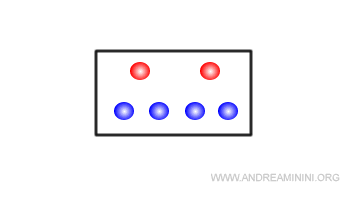
Dopo la reazione il sistema si sposta in un nuovo equilibrio dinamico caratterizzato da una maggiore quantità di molecole allo stato liquido e una minore quantità allo stato aeriforme, rispetto all'equilibrio precedente.
Poiché il liquido occupa meno volume del vapore, la pressione interna scende.
In questo modo il sistema riduce l'effetto ( pressione interna ) della riduzione del volume del recipiente (perturbazione esterna).
E così via.
