Elettroliti
Gli elettroliti sono composti chimici che si dissociano totalmente o parzialmente in ioni quando si trovano in una soluzione acquosa.
Sono elettroliti i sali ,gli acidi e la basi.
- I sali sono caratterizzati da legami ionici e si dissociano in ioni positivi e negativi.
- Gli acidi e le basi, invece, sono molecole polari che si ionizzano nell'acqua.
Grazie alla presenza degli elettroliti (ioni), le soluzioni acquose diventano buoni conduttori di elettricità.
Gli elettroliti ionici
Gli elettroliti ionici derivano dalla dissociazione di un solido ionico (sali) in una soluzione acquosa.
In un solido ionico gli ioni positivi (cationi) e negativi (anioni) sono legati tra loro dalla forza elettrostatica.
Esempio. Il cloruro di sodio (NaCl) è un esempio pratico di solido ionico. L'atomo di sodio (Na+) è uno ione positivo (catione) mentre l'atomo di cloro (Cl-) è uno ione negativo (anione). Le forze elettrostatiche opposte legano tra loro gli ioni in un cristallo.
Le molecole d'acqua (H2O), invece, sono molecole polari perché hanno una frazione di carica negativa sull'atomo di ossigeno e una frazione di carica positiva sugli atomi di idrogeno.
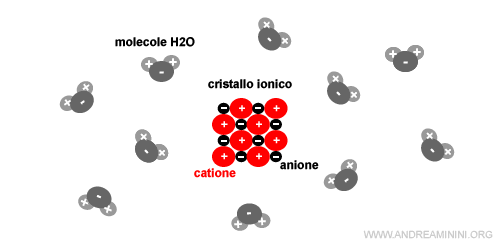
Una volta immerso il solido ionico in un acqua, le molecole d'acqua (solvente) si legano con gli ioni presenti nel cristallo ionico.
La frazione positiva della molecola d'acqua si lega con gli ioni negativi mentre la frazione negativa con gli ioni positivi.
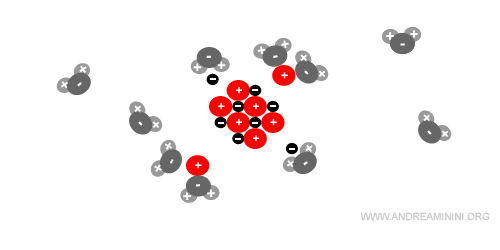
Man mano che le molecole si orientano e si legano agli ioni, si riduce la forza di attrazione tra gli ioni di segno opposto nel cristallo, fino alla rottura del legame ionico.
Quando uno ione si stacca dal cristallo (elettrolita ionico) viene immediatamente circondato da altre molecole d'acqua tramite legami dipolari (idratazione).
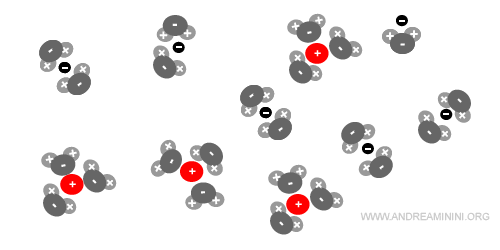
Il processo di ionizzazione continua fino alla scomparsa del cristallo ionico.
Gli elettroliti molecolari
Gli elettroliti molecolari derivano dalla dissociazione di un composto molecolare in una soluzione acquosa.
Il composto molecolare non contiene ioni ma quando è a contatto con l'acqua tra le molecole d'acqua e quelle della sostanza pura si verifica il processo di ionizzazione.
Esempio
In questa reazione
$$ HCl_{(aq)} + H_2O_{(l)} \rightarrow Cl^-_{(aq)} + H_3O^+_{(aq)} $$
La molecola HCl cede un protone H+ alla molecola d'acqua.
E così via.
