Legame covalente omopolare
Cos'è il legame covalente omopolare
Il legame covalente omopolare è un legame covalente che si forma tra due o più atomi dello stesso elemento chimico.
Si chiama "omopolare" perché la polarità è la stessa. E' anche detto legame covalente puro.
Permette agli atomi di legarsi tra loro mettendo in comune una o più coppie di elettroni per raggiungere la configurazione elettronica stabile del gas nobile più vicino.
Le coppie di elettroni che contribuiscono al legame chimico sono dette coppie di legame,
Un esempio pratico
Esempio 1 ( molecola di idrogeno )
La molecola di idrogeno H2 è l'esempio più semplice di legame covalente omopolare.
Un atomo di idrogeno ha un solo elettrone di valenza nell'orbitale s. La sua configurazione elettronica è 1s1.
Per raggiungere la stabilità deve raggiungere la configurazione elettronica del gas nobile più vicino ossia l'elio (1s2).
Nota. L'elio è l'unico gas nobile a raggiungere la stabilità con due elettroni (duetti). Tutti gli altri gas nobili hanno otto elettroni (ottetto).
Pertanto, l'atomo di idrogeno ha bisogno di un altro elettrone di valenza.
Quando due atomi di idrogeno si avvicinano alla distanza di legame, ogni atomo mette in comune il proprio elettrone.
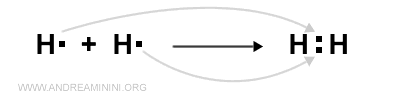
Nota. Per semplicità in questi esempi uso le formule di Lewis. Ogni simbolo dell'elemento chimico è un atomo mentre ogni punto intorno al simbolo dell'elemento chimico è un elettrone di valenza dell'atomo.
I due elettroni spaiati, detti coppia di legame, cominciano a orbitare sia sull'orbitale s del primo atomo che sul secondo.
In alcuni momenti entrambi gli elettroni orbitano sullo stesso atomo permettendogli di raggiungere la configurazione elettronica dell'elio (1s2).

Pertanto, grazie alla coppia di elettroni in comune entrambi gli atomi di idrogeno possono raggiungere la configurazione elettronica stabile dell'elio (duetto).

La condivisione della coppia di elettroni crea un legame chimico molto forte.
Basti pensare che l'energia di legame in una molecola di idrogeno H2 è circa 430 kJ/mol.
Esempio 2 ( molecola di cloro )
Una molecola di cloro Cl2 è un altro esempio di legame covalente puro.
Un atomo di cloro ha 7 elettroni di valenza (3s2 3p5) e nel sistema periodico il gas nobile più vicino è l'argon (3s2 3p6).
Nota. Come tutti i gas nobili, tranne l'elio, l'argon ha otto elettroni (ottetto) nella sua configurazione elettronica superficiale. Da questo deriva la regola nota come regola dell'ottetto.
Quindi l'atomo di cloro ha bisogno di un elettrone per raggiungere la stabilità dell'argon.
Quando due atomi di cloro si avvicinano alla distanza di legame, ogni atomo di cloro mette in comune un elettrone.
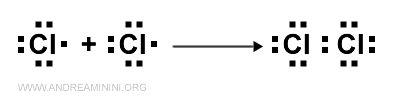
I due elettroni spaiati formano una coppia di legame.

La condivisione della coppia di elettroni di valenza crea un legame covalente puro tra i due atomi, formando la molecola biatomica di cloro Cl2.
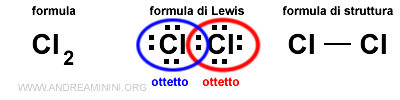
Nota. Tutti gli altri elementi chimici del gruppo VII A ( elementi alogenti ) hanno lo stesso comportamento del cloro, formano delle molecole biatomiche tramite il legame covalente puro.
Esempio 3 ( molecola di ossigeno )
La molecola di ossigeno O2 è un altro esempio di legame di valenza.
Un atomo di ossigeno ha 6 elettroni di valenza (2s2 2p4) e nel sistema periodico il gas nobile più vicino è il neon (2s2 2p6).
Quindi l'ossigeno ha bisogno di due elettroni di valenza.
Quando due atomi di ossigeno si avvicinano alla distanza di legame, ogni atomo mette in comune due elettroni di valenza.
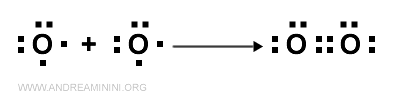
Complessivamente ci sono quattro elettroni spaiati in comune tra i due atomo che formano due coppie di elettroni (coppie di legame).

Le due coppie di elettroni formano un legame covalente doppio che permette a entrambi gli atomi di raggiungere la configurazione stabile del neon.
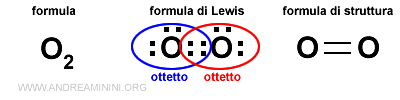
Si forma così una molecola biatomica di ossigeno O2.
Esempio 4 ( molecola di azoto )
La molecola di azoto N2 è un altro esempio pratico di legame covalente puro.
Un atomo di azoto ha 5 elettroni di valenza (2s2 2p3).
Per raggiungere la configurazione stabile del neon (2s2 2p6), il gas nobile più vicino per numero atomico, l'atomo di azoto ha bisogno di tre elettroni.
Quando due atomi di azoto si avvicinano alla distanza di legame, ogni atomo mette a disposizione tre elettroni.
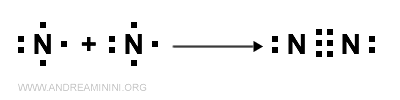
In tutto ci sono sei elettroni spaiati che formano tre coppie di legame covalente.

Il triplo legame covalente permette a entrambi gli atomi di azoto di raggiungere la stabilità del neon.

Si forma così la molecola biatomica di azoto N2.
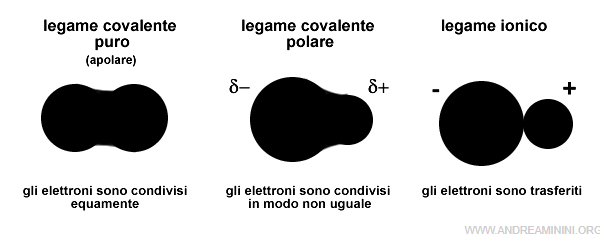
La polarità del legame covalente apolare
In un legame covalente apolare tra atomi uguali il baricentro delle cariche positive coincide con quello delle cariche negative e si trova tra i i due atomi.
La distribuzione degli elettroni tra gli atomi legati è uguale e simmetrica.
E così via.
