Legame covalente polare
Cos'è il legame covalente polare
Il legame covalente polare è un legame covalente tra due o più atomi di elementi chimici diversi.
E' anche detto legame covalente eteropolare.
Ogni atomo mette in comune uno o più elettroni formando delle coppie di legame.
Nota. In genere, il legame covalente polare si forma tra atomi degli elementi chimici con un'elettronegatività inferiore a 1.7
Come si forma il legame covalente polare
Nel legame covalente polare ogni atomo mette a disposizione uno o più elettroni che formano delle coppie di elettroni (o coppie legame).
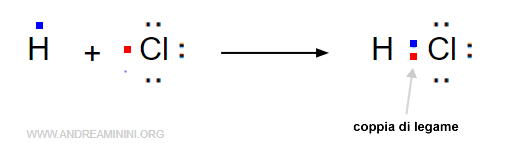
Le coppie di elettroni orbitano intorno a entrambi gli atomi.
Tuttavia, sono maggiormente attratte dall'atomo più elettronegativo.
Quindi, è molto più probabile trovare gli elettroni orbitare intorno all'atomo elettronegativo piuttosto che nell'altro.
La nube elettronica della molecola è asimmetrica, è più addensata intorno all'atomo più elettronegativo.
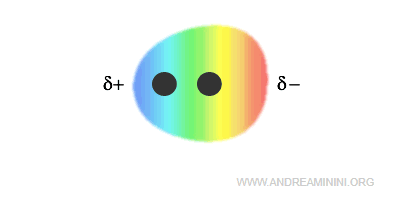
Pertanto, l'atomo più elettronegativo assume una parziale carica negativa (δ-), mentre l'atomo meno elettronegativo assume una parziale carica positiva (δ+).
In questo caso la molecola è detta molecola polare mentre il legame è detto legame polare.
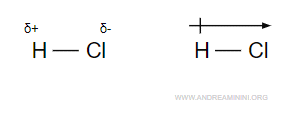
La seconda notazione indica il verso dello spostamento delle cariche negative.
Complessivamente la molecola è sempre neutra ma diventa un dipolo.
Un dipolo elettrico è composto da una carica positiva +q situata a una distanza d da un'uguale carica negativa -q ed è caratterizzato dal un momento dipolare.
Perché la carica è parziale? A differenza del legame ionico, nel legame covalente polare gli elettroni non si trasferiscono definitivamente da un atomo all'altro come nel legame ionico. Gli elettroni continuano a orbitare intorno a tutti gli atomi della molecola, anche se con maggiore probabilità sugli orbitali dell'atomo più elettronegativo. In alcuni istanti la molecola è apolare, in altri polare.
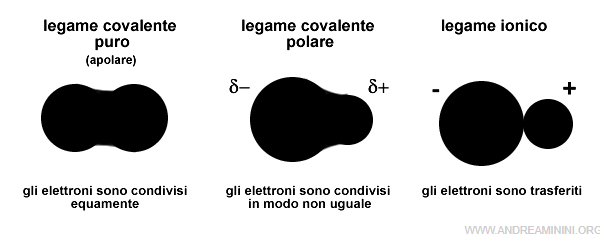
Pertanto, il legame covalente polare è più forte del legame covalente puro (apolare) perché è rafforzato dall'attrazione elettrostatica tra le parziali cariche opposte degli atomi.
Tuttavia, nelle molecole con più di due atomi non è detto che accada sempre, perché il momento dipolare dipende anche dalla struttura geometrica delle molecole.
Un esempio pratico
Il cloruro di idrogeno è una molecola biatomica composta da un atomo di idrogeno (H) e un atomo di cloro (Cl).
$$ HCl $$
La configurazione elettronica dell'idrogeno è 1s1. Ha un solo elettrone nel primo orbitale s.
Quindi, all'idrogeno manca un elettrone per raggiungere la configurazione stabile dell'elio (1s2).
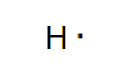
La configurazione elettronica superficiale del cloro (Cl) è 3s2 3p5. Ha 7 elettroni di valenza nello strato più esterno.
Quindi, all'idrogeno manca un solo elettrone per raggiungere la configurazione stabile del gas nobile più vicino nel sistema periodico, ossia l'argon (3s2 3p6).
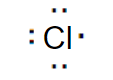
Quando l'atomo di cloro e di idrogeno sono abbastanza vicini alla distanza di legame, ogni atomo mette in comune un elettrone.
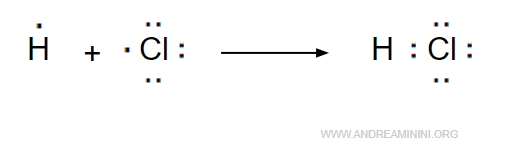
Si forma una coppia di elettroni che orbita intorno a entrambi gli atomi legandoli tra loro con il legame covalente.
In questo caso si tratta di un legame semplice perché c'è una sola coppia di elettroni in comune.
La coppia di elettroni permette all'atomo di idrogeno di raggiungere la configurazione stabile dell'elio (duetto) e all'atomo di cloro di raggiungere quella dell'argon, secondo la regola dell'ottetto.
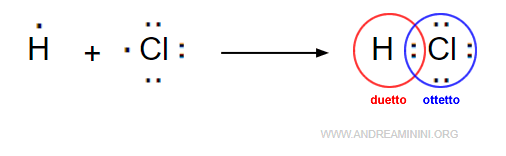
Il legame covalente è stabile perché gli atomi legati raggiungono un livello di energia potenziale più basso ( energia di legame ).
Poiché il cloro è più elettronegativo dell'idrogeno, la coppia di elettroni tende a orbitare più frequentemente intorno all'atomo di cloro.
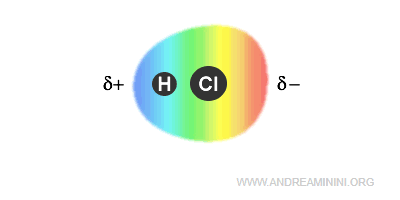
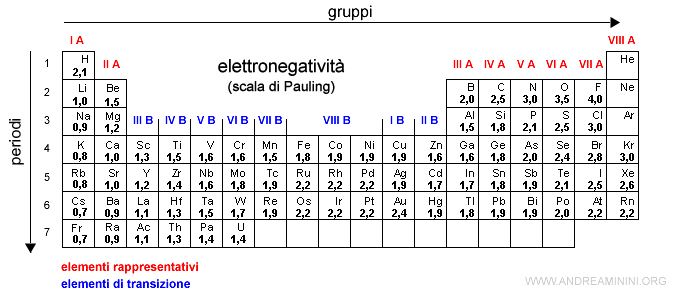
Nota. L'elettronegatività del cloro è 3.16 mentre quella dell'idrogeno è 2.2
Quindi, l'atomo di cloro acquista una parziale carica negativa (δ-).
L'atomo di idrogeno, invece, acquista una parziale carica positiva (δ+).
Esempio 2
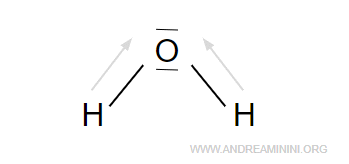
Una molecola d'acqua è composta da un atomo di ossigeno e due di idrogeno
$$ H_2 O $$
All'idrogeno manca un elettrone di valenza per avere la configurazione elettronica dell'elio (1s2).
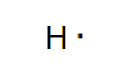
All'ossigeno (2s2 2p4) mancano due elettroni di valenza per raggiungere la configurazione elettronica del gas inerte più vicino, ossia il neon (2s2 2p6)
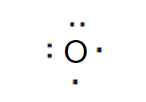
Alla distanza di legame ogni atomo di idrogeno mette a disposizione un elettrone, mentre l'atomo di ossigeno ne mette a disposizione due. In tutto ci sono quattro elettroni in comune.
Si formano così due coppie di legame covalente che formano la molecola d'acqua.
In questo caso ci sono due legami covalenti.
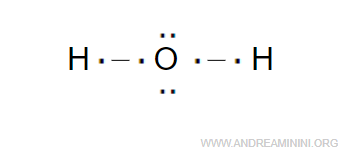
Poiché l'ossigeno è più elettronegativo (3.44) dell'idrogeno (2.2), nella molecola le coppie di elettroni tendono a orbitare di più intorno all'atomo di ossigeno.
Quindi, nella molecola H2O l'atomo di ossigeno ha una parziale carica negativa, mentre gli atomi di idrogeno hanno una parziale carica positiva.
Nota. Per la precisione la formula di struttura dell'acqua non è simmetrica e lineare. Si tratta di una molecola angolare perché i legami formano un angolo. Questo si può dedurre studianto la sua costante dielettrica.
Esempio 3
Il perossido di idrogeno è una molecola H2O2 composta da due atomi di idrogeno e due atomi di ossigeno.
$$ H_2O_2 $$
Ogni atomo di idrogeno condivide un elettrone, mentre ogni atomo di ossigeno condivide due elettroni.
Complessivamente, gli atomi condividono sei elettroni che formano tre coppie di legame.
Una coppia di legame è condivisa tra i due atomi di ossigeno.
Le altre due coppie di legame legano ogni atomo di ossigeno a un atomo di idrogeno.
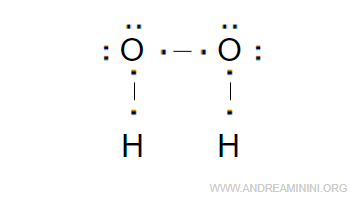
Anche in questo caso gli atomi di ossigeno hanno una parziale carica negativa (δ-), mentre gli atomi di idrogeno una parziale carica positiva (δ+).
La covalenza
La covalenza (o valenza covalente) è il numero di coppie di elettroni che un elemento chimico può condividere con altri atomi in un composto.
Esempio 1
L'idrogeno (H) è monocovalente perché può condividere un solo elettrone.
Quindi può formare una sola coppia di elettroni.
Esempio 2
L'ossigeno (O) è bicovalente perché può condividere due elettroni.
Quindi può formare due coppie di elettroni di legame.
Esempio 3
L'azoto (N) è tricovalente perché può condividere tre elettroni.
Pertanto, può formare tre coppie di legame covalente.
Esempio 4
Il carbonio (C) è tetracovalente perché può condividere quattro elettroni di valenza.
Quindi, può formare quattro coppie di elettroni.
La polarità del legame covalente polare
In un legame covalente polare tra atomi diversi il baricentro delle cariche positive è più vicino all'atomo più elettronegativo.

La percentuale di carattere ionico
Un legame covalente tra atomi differenti ha un parziale carattere ionico che è tanto più grande, quanto più è marcata la differenza di elettronegatività tra gli atomi.
Si misura in percentuale di carattere ionico.
La percentuale di carattere ionico è il rapporto tra il momento dipolare (μ) della molecola Aδ+Bδ- e il momento dipolare del composto ionico (e·d) tra gli ioni A+B-. $$ P_{carattere \: ionico} = \frac{μ}{e \cdot d} \cdot 100 $$
Dove e è la carica dell'elettrone mentre d è la distanza di legame.
Quando la percentuale di carattere ionico oltrepassa il 50% si parla di legame ionico.
Nota. Generalmente, il legame covalente si forma quando tutti gli elementi chimici appartengono al blocco p (gruppi V, VI e VII A). Nel legame ionico, invece, in genere un elemento chimico appartiene al blocco s (gruppi I e II A).
E così via
