Prima legge di Gay Lussac
Cosa dice la prima legge di Gay Lussac
A parità di pressione (P) e numero di moli (n) del gas, il volume (V) di una massa di qualsiasi gas aumenta di 1/273,15 del suo valore iniziale (V0) per ogni incremento di un grado temperatura (t). $$ V=V_0(1+αt) \:\:\: (P,n) $$ E' anche nota come legge di Charles-Gay Lussac o legge isobara.
Dove le parentesi tonde (P,n) indicano che la pressione e la quantità del gas (numero di moli) sono costanti.
Il coefficiente alfa (α) è, invece, il coefficiente di dilatazione termica del gas pari a 1/273,15.
$$ α=\frac{1}{273,15} $$
Poiché α è una costante, si deduce che anche il rapporto tra volume e temperatura è costante.
$$ V=V_0(1+at) $$
$$ V=V_0(1+\frac{1}{273,15}t) $$
$$ V = V_0 ( \frac{273,15+t}{273,15}) $$
Considerando che 273,15+t(°C) è pari alla temperatura assoluta in scala Kelvin, ossia T(K)=273,15+t(°C)
$$ V = V_0 ( \frac{T}{273,15} ) $$
Nota. La variabile t minuscola indica la temperatura centigrada sulla scala Celius mentre la variabile T maiuscola indica la temperatura assoluta sulla scala Kelvin.
Al denominatore 273,15 K equivale a zero gradi centigradi 0°C e posso indicarla come temperatura iniziale del gas T0
$$ V = V_0 ( \frac{T}{T_0} ) $$
Con un semplice passaggio algebrico dimostro che il rapporto tra volume e temperatura è costante al variare della temperatura
$$ \frac{V}{T} = \frac{V_0}{T_0} $$
Quindi, la prima legge di Gay Lussac individua una relazione proporzionale diretta tra il volume (V) e la temperatura (t) del gas.
Nota. La stessa relazione diretta tra volume e temperatura si verifica anche in gran parte dei solidi. Non solo dei gas.
La legge di Charles-Gay Lussac è rappresentabile con una semiretta su un diagramma cartesiano.
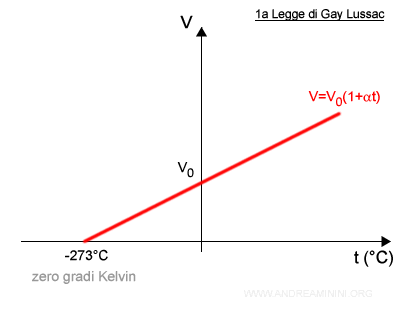
La retta ha origine da -273,15°C (Celsius) ossia da 0 K (Kelvin), considerata la temperatura più bassa possibile ( zero assoluto ).
Il coefficiente angolare della retta è pari al rapporto costante tra volume e temperatura del gas.
Nota. Lo zero assoluto (-273.15°C) è la temperatura più bassa possibile. A questa temperatura si interrompono le vibrazioni degli atomi e i movimenti termici. Non c'è temperatura inferiore. Secondo il modello grafico allo zero assoluto il gas è privo di volume. Il che può sembrare paradossale ma non lo è. Questo accade perché la legge si basa su modello teorico dei gas ideali che, per definizione, sono teoricamente puntiformi. Non essendoci più vibrazioni, i punti sono privi di volume.
Perché il volume aumenta con la temperatura?
L'incremento della temperatura fornisce energia alle particelle (molecole/atomi) dei gas.
Questo aumento di energia aumenta il range della distanza di legame tra gli atomi.
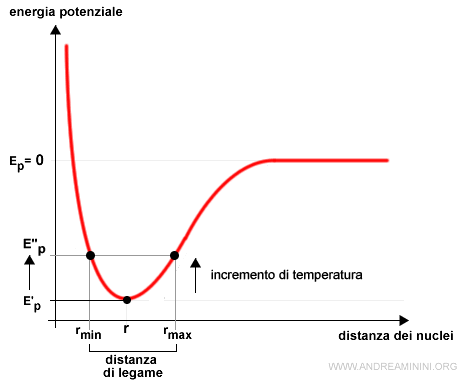
L'incremento della distanza di legame a livello atomico si traduce su scala in un aumento del volume del gas.
E così via.
