Seconda legge di Gay Lussac
Cosa dice la seconda legge di Gay Lussac
A parità di volume (V) e numero di moli (n) del gas, la pressione (P) di un gas aumenta di 1/273,15 del suo valore iniziale (P0) per ogni incremento di un grado di temperatura. $$ P = P_0(1+αt) \:\:\: (V,n) $$ E' anche nota come legge isocora.
Le variabili tra parentesi (V,n) sono costanti.
La variabile P0 è la pressione iniziale del gas mentre P è la pressione finale dopo la variazione di temperatura (t).
Pertanto, tra pressione e temperatura si rileva una relazione direttamente proporzionale in cui il rapporto tra pressione e temperatura è costante.
$$ \frac{P}{T} = \: costante $$
Dove T è la temperatura assoluta misurata sulla scala Kelvin.
Dimostrazione. Il coefficiente α è detto coefficiente di dilatazione termica e coincide con la prima legge di Gay Lussac $$ α = \frac{1}{273,15} $$ Sostituendo il coefficiente α nella relazione ottengo $$ P = P_0(1+αt) $$ $$ P = P_0(1+ \frac{1}{273,15} t) $$ $$ P = P_0( \frac{273,15+t}{273,15} ) $$ Dove 273,15 è la temperatura assoluta iniziale T0 (equivalente a 0°C) mentre 273,15+t è la temperatura assoluta finale, entrambe misurate sulla scala Kelvin T. $$ P = P_0( \frac{T}{T_0} ) $$ Con un semplice passaggio algebrico diventa $$ \frac{P}{T} = \frac{P_0}{T_0} $$ Pertanto, il rapporto P/T iniziale e finale è lo stesso.
La seconda legge di Gay Lussac è rappresentabile con una semiretta su un diagramma cartesiano.
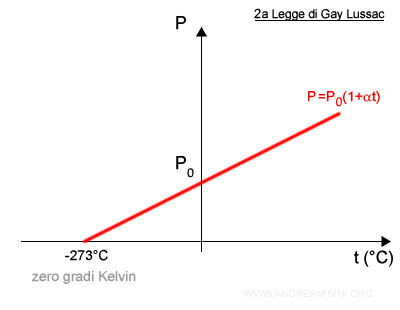
La semiretta ha origine allo zero assoluto (-273°C) ossia 0 K (zero Kelvin o zero assoluto), considerata la temperatura più bassa possibile.
Il coefficiente angolare della semiretta è uguale al rapporto tra pressione e temperatura (P/T).
Nota. Allo zero termico la pressione teoricamente si annulla perché cessano tutti i movimenti termici delle particelle. Poiché un gas non può avere pressione negativa, lo zero assoluto è considerata la temperatura più bassa possibile in natura. La legge di Gay Lussac è una delle leggi dei gas elaborate sul modello teorico dei gas ideali (o gas perfetti) e un gas ideale è puntiforme. Quindi, in assenza di movimenti termici ogni punto non occupa spazio. Si tratta ovviamente di una semplificazione teorica.
E così via.
