Legge di Boyle
Cosa dice la legge di Boyle
A parità di temperatura t e numero di moli n, il volume V di un gas è inversamente proporzionale alla pressione P. $$ P \cdot V = costante \:\: (t,n) $$
Dove i simboli tra parentesi (t,n) vogliono dire che la temperatura (t) e le moli (n) del gas sono costanti.
Robert Boyle si accorse dell'esistenza di una relazione tra il volume e la pressione di una quantità di moli (o massa) di un gas quando la temperatura è costante.
Nota. In genere è preferibile indicare la quantità del gas in numero di moli anziché di massa.
Posso rappresentare la legge di Boyle su un diagramma cartesiano con un'iperbole equilatera.
E' anche detta curva isoterma perché la temperatura è costante.
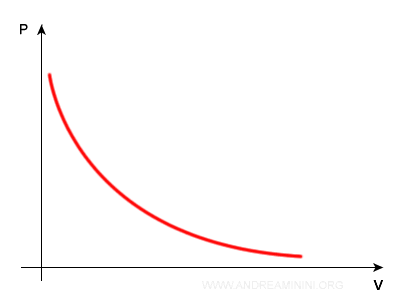
In ogni punto dell'iperbole il prodotto PV è costante.
Quando la pressione raddoppia, il volume di dimezza.
La variazione della temperatura
Nella legge di Boyle la temperatura è una costante.
Misurando i campioni di pressione e volume a diverse temperature si ottengono diverse iperboli.
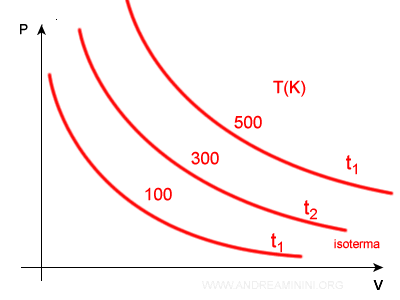
A ogni temperatura T(K) è associata una iperbole isoterma. Quelle più esterne indicano una temperatura superiore.
In ogni isoterma la relazione tra pressione e volume è sempre inversamente proporzionale.
E così via.
