La cinetica chimica
La cinetica chimica studia la velocità in cui si svolgono le reazioni chimiche, detta velocità di reazione.
Cos'è la velocità di reazione
La velocità di reazione è la variazione della concentrazione dei reagenti e dei prodotti in un intervallo di tempo.
Nota. Alcune reazioni chimiche sono lente (es. ossidazione), altre veloci (es. combustione) e persino istantanee (es. esplosione).
In una reazione chimica generica, la quantità dei reagenti tende a ridursi nel tempo mentre quella dei prodotti a crescere.
$$ A+B \rightarrow C+D $$
Questo accade fino all'esaurimento dei reagenti nelle reazioni irreversibili ( reazione completa ).
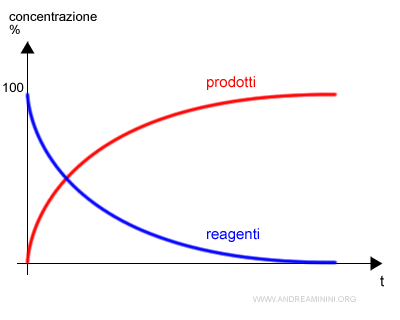
Nel caso caso della reazione incompleta, invece, il processo si arresta prima dell'esaurimento dei reagenti quando la reazione raggiunge un equilibrio chimico dinamico.
In equilibrio chimico la reazione chimica è perfettamente reversibile e il flusso dai reagenti ai prodotti è compensato da un flusso uguale e contrario dai prodotti a reagenti.
In ogni caso la velocità di reazione va studiata in ogni istante del processo, perché può subire sensibili variazioni nel corso del tempo.
Uno degli obiettivi della cinetica chimica è individuare una legge che sia in grado di spiegare la relazione tra la concentrazione dei reagenti e la velocità della reazione.
$$ v = k X_A^{\alpha} + X_B^{\beta} $$
Dove k è una costante di proporzionalità detta costante cinetica, XA e XB sono le concentrazioni dei reagenti mentre gli esponenti alfa e beta sono impostati in modo tale da far coincidere la legge con i dati sperimentali osservati.
Nota. La costante cinetica non è generale perché cambia in funzione della temperatura e della reazione chimica che si studia.
Ovviamente, non è detto che esista sempre una legge per ogni reazione chimica.
Quali fattori determinano la velocità di reazione
La velocità di reazione può dipendere da diversi fattori
- La concentrazione dei reagenti
La velocità di reazione è correlata direttamente alla concentrazione dei reagenti. Se la concentrazione dei reagenti è alta, rispetto ai prodotti, la velocità di reazione è maggiore. Rallenta man mano che si riduce la concentrazione dei reagenti. - La temperatura
In genere la velocità di reazione è correlata direttamente alla temperatura, sia nei processi endotermici che esotermici. Quindi, all'aumentare della temperatura si incrementa anche la velocità di reazione. - Il legame chimico dei reagenti
Quando il legame chimico dei reagenti è molto forte, la velocità di reazione è più bassa se la reazione implica la rottura del legame. Ad esempio, la reazione di reagenti con legami ionici è più veloce rispetto a quelli con legame covalente.Nota. Ovviamente questo vale solo se la reazione chimica implica la rottura del legame.
- Suddivisione del reagente solido
Se i reagenti in stati fisici diversi (soluzione eterogenea) in cui un reagente è solido, la velocità di reazione è maggiore se il reagente solido è suddiviso in più parti, perché aumenta la superficie di contatto con gli altri reagenti. Se invece il reagente solido è concentrato in un unico blocco, la superficie di contatto è minore e la velocità è più bassa. - Presenza di catalizzatori
La velocità di reazione può essere aumentata tramite il fenomeno della catalisi, aggiungendo nella reazione chimica delle sostanze specifiche dette catalizzatori che hanno l'effetto di accelerare il processo senza consumarsi.
E così via.
