Momento dipolare
Cos'è il momento dipolare
In un legame covalente il momento dipolare (μ) è il prodotto tra il valore assoluto di una carica dei due atomi (δ) e la distanza (d) dei nuclei atomici.
E' una grandezza vettoriale parallelo al legame chimico con modulo |μ| e una direzione che congiunge le due cariche.
Per convenzione, il verso del vettore è dall'atomo meno elettronegativo (carica positiva) a quello più elettronegativo (carica negativa).
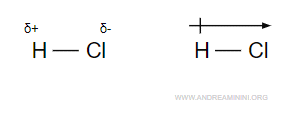
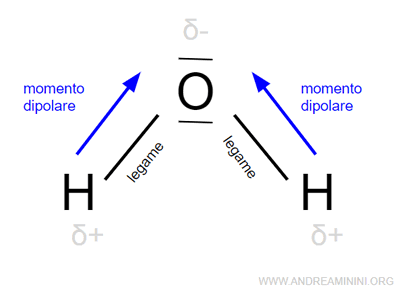
Se la molecola è composta da più legami chimici, il momento dipolare è approssimabile come somma vettoriale dei momenti dipolari di tutti i legami chimici.
Qual è l'unità di misura? Nel sistema internazionale il momento dipolare si misura in Coulomb per metri C·m. Tuttavia, nelle molecole il momento dipolare spesso si misura in debye (D) in quanto è un unità di misura molto piccola. $$ 1 \: D = 3,336 \cdot 10^{-30} C \cdot m $$
A cosa serve il momento dipolare?
Il momento dipolare misura la polarità di un legame chimico e la tendenza del dipolo a orientarsi per effetto di un campo elettrico.
Una molecola polare ha al suo interno una carica positiva e una negativa.
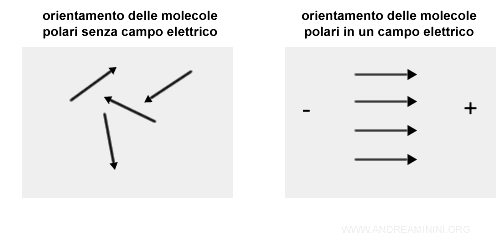
Quindi, la molecola tende a cambiare il propio orientamento nello spazio quando è vicina a campi elettrici esterni.
Inoltre, il confronto tra il momento dipolare e la costante dielettrica mi fornisce informazioni utili sulla forma della molecola e sulla geometria molecolare.
La costante dielettrica
Cos'è la costante dielettrica
La costante dielettrica (ε) è una misura sperimentale del momento dipolare di una sostanza.
Se una sostanza ha un elevato valore della costante dielettrica, è composta da molecole polari.
Qual è la differenza tra costante dielettrica e momento dipolare? La costante dielettrica è un valore misurato a livello sperimentale. Il momento dipolare è, invece, un calcolo teorico che può essere confermato o meno dalla costante dielettrica.
Un esempio pratico
La molecola d'acqua è composta da due atomi di idrogeno e un atomo di ossigeno.
$$ H_2 O $$
Qual è la forma della molecola H2O?
Potrei scrivere la formula di struttura nel seguente modo
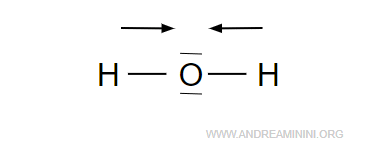
Questa formula di struttura lascia intendere che la molecola d'acqua ha una forma simmetrica e lineare. In realtà non è così.
In una struttura lineare e simmetrica il momento dipolare è nullo, perché la somma vettoriale dei due momenti dipolari nei due legami è nulla.
Nota. In una struttura lineare e simmetrica i due legami hanno un momento dipolare uguale e opposto. Quindi, la sua costante dielettrica dovrebbe essere nulla.
Tuttavia, andando a misurare la costante dielettrica dell'acqua mi accorgo che è pari a ε=80. Non è nulla.
Quindi, la forma della molecola non può essere lineare e simmetrica.
Soltanto una forma angolare è compatibile con la costante dielettrica ε=80.
Da questo deduco che la molecola d'acqua è una molecola angolare.
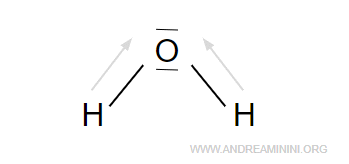
Ho così studiato la geometria molecolare dell'acqua.
Esempio 2
La molecola di anidride carbonica (o biossido di carbonio) è composta da un atomo di carbonio (C) e due atomi di ossigeno (O)
$$ CO_2 $$
La costante dielettrica dell'anidride carbonica è ε=0.
Da questo deduco che la molecola di CO2 ha una forma lineare e simmetrica perché è l'unica in cui la somma vettoriale dei momenti dipolari è uguale a zero
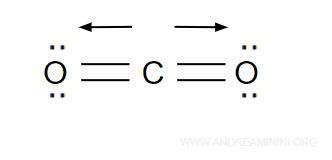
Nota. L'atomo di carbonio (2s2 2p2) mette a disposizione 4 elettroni di valenza mentre ogni atomo di ossigeno (2s2 2p4) mette a disposizione 2 elettroni di valenza. In questo modo, grazie agli elettroni condivisi, gli atomi di carbonio e di ossigeno possono raggiungere la configurazione del neon.
E così via.
