Liquefazione del gas
Il processo di liquefazione di un gas è il passaggio dallo stato aeriforme allo stato liquido che si verifica in particolari condizioni di temperatura e pressione.
La liquefazione del gas si verifica quando le particelle sono abbastanza vicine e poco veloci da attrarsi reciprocamente.
Questo si verifica quando
- La pressione molto alta avvicina le particelle tra loro.
- La temperatura molto bassa riduce il moto delle particelle del gas, rendendole più soggette alla forza di attrazione reciproca.
Nota. Quando la temperatura è bassa e la pressione è alta, le forze intermolecolari non sono più trascurabili ed è possibile il cambiamento di stato da aeriforme a liquido.
Il processo di liquefazione cambia a seconda della natura chimica del gas.
La temperatura critica di liquefazione
La temperatura critica è la temperatura più alta in cui il processo di liquefazione è possibile.
Ogni gas è caratterizzato da una propria temperatura critica di liquefazione.
Al di sopra della temperatura critica è impossibile liquefare il gas con qualsiasi aumento della pressione.
La pressione necessaria per avviare il processo di liquefazione della sostanza aeriforme alla sua temperatura critica è detta pressione critica.
La differenza tra gas e vapore
In base alla propria temperatura critica le sostanze aeriforme si distinguono in gas e vapori
- Gas
I gas non sono liquefacibili. Si trovano a una temperatura superiore alla propria temperatura critica. - Vapori
I vapori sono liquefacibili. Si trovano a una temperatura inferiore alla propria temperatura critica.
Pertanto, una sostanza aeriforme è un gas se si trova al di sopra della temperatura critica, è un vapore se si trova al di sotto della temperatura critica
I diagrammi di Andrews
I diagrammi di Andrews sono una rappresentazione grafica della relazione tra pressione (P) e volume (V) di una sostanza aeriforme (gas o vapore) a parità di temperatura T tramite delle curve isoterme (stessa temperatura).
Quando una sostanza aeriforme si trova al di sopra della propria temperatura critica (T>Tc), il processo di liquefazione non è possibile.
In questo caso l'isoterma è quella tipica di un gas che conferma la legge di Boyle.
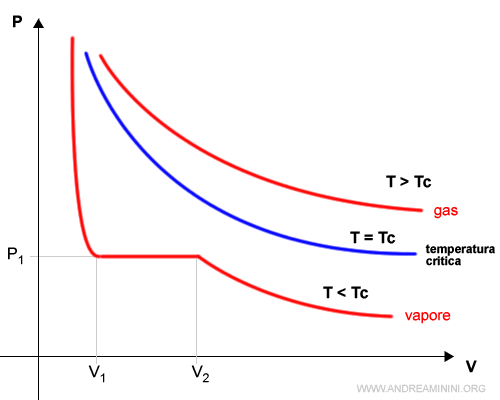
Quando la temperatura si trova al di sotto della propria temperatura critica (T<Tc) la curva diventa prima orizzontale, poi quasi verticale man mano che la pressione aumenta.
Perché? Quando la pressione aumenta al livello P1, l'isoterma del vapore diventa orizzontale perché la sostanza aeriforme diventa liquida. Il volume occupato dalla materia si riduce rapidamente da V2 a V1 perché il liquido occupa molto meno spazio rispetto al vapore. Successivamente la curva diventa quasi verticale perché il liquido è meno comprimibile del vapore con l'aumento della pressione (P>P1).
E così via.
