Il nucleo atomico
Il nucleo atomico è la parte centrale dell’atomo, piccolissima rispetto alle sue dimensioni complessive. È formato da protoni, con carica positiva, e da neutroni, elettricamente neutri. Contiene quasi tutta la massa dell’atomo ed è tenuto insieme dalla forza nucleare forte.
Il nucleo atomico è formato dall'unione di diverse particelle subatomiche: i protoni e i neutroni.
- Protoni. Sono particelle subatomiche con carica elettrica positiva. Un protone ha una massa pari a 1,6726·10-27 kg e una carica elettrica positiva pari a +1,6022·10-19 C.
- Neutroni. Sono particelle subatomiche con carica elettrica neutra. Un neutrone ha una massa pari a 1,6749·10-27 kg, leggermente più grande rispetto al protone. Non ha carica elettrica. Per questo motivo è detto neutrone.
I protoni e i neutroni sono particelle subatomiche nucleari e sono detti nucleoni. Una rappresentazione tradizionale dell'atomo è la seguente:
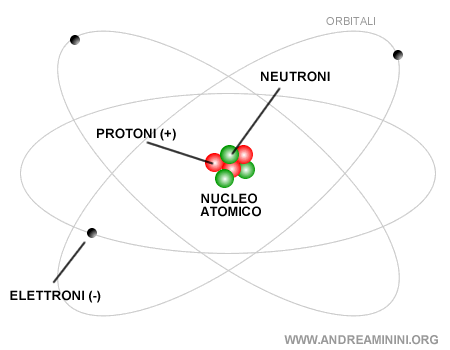
Nota. I protoni e i neutroni sono notevolmente più grandi rispetto agli elettroni, circa 1835 volte più massivi. La massa di un elettrone è 9,109534·10-31 kg, quella di un neutrone e di un protone è invece su una scala più grande, circa 1,6·10-27 kg. Per un confronto, se l'elettrone fosse una bottiglia da un litro, il protone sarebbe un furgone.

Le dimensioni del nucleo
Il nucleo di un atomo occupa uno spazio minimo rispetto a quello occupato dalle orbite dell'atomo.
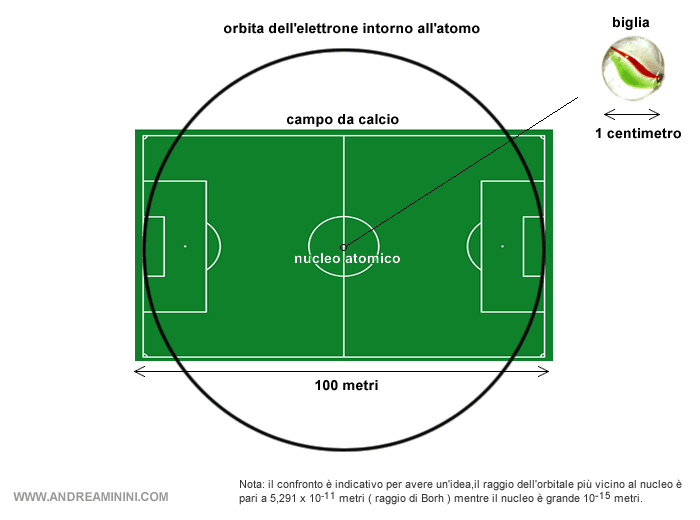
Le dimensioni del nucleo sono di 10-15 metri. E' circa diecimila volte più piccolo dell'atomo per intero, quest'ultimo è grande circa 10-11.
Qual è la carica elettrica del nucleo atomico
Il nucleo atomico ha una carica elettrica positiva.
La carica elettrica del nucleo è determinata soltanto dai protoni, poiché i neutroni sono neutri ( privi di carica elettrica ) e non influiscono su questo aspetto.
Ogni protone ha una carica elettrica positiva pari a +1,6022 x 10-19 C. Per questa ragione il nucleo atomico ha una carica elettrica positiva.
In un atomo neutro la carica elettrica positiva del nucleo è uguale alla carica elettronica negativa degli elettroni, le particelle subatomiche che orbitano intorno al nucleo.
Nota. Un elettrone ha la stessa carica elettrica di un protone ma con segno opposto, quindi -1,6022 x 10-19 C. Pertanto, in un atomo neutro il numero dei protoni eguaglia sempre il numero degli elettroni.
Chi ha scoperto i protoni?
La presenza dei protoni fu ipotizzata da Ernest Rutherford nel 1911. Fu una deduzione, poiché a quell'epoca erano stati rilevati gli elettroni negli orbitali ma non ancora il nucleo.
Gli elettroni sono particelle di carica negativa ma l'atomo è neutro. Pertanto, devono esserci nell'atomo anche delle particelle di carica uguale e opposta ( positiva ) per bilanciare gli elettroni.
Rutherford ipotizzò la presenza dei protoni nel nucleo atomico.
Nota. Gli esperimenti sulle radiazioni nei tubi catodici avevano già provato l'esistenza delle particelle cariche positivamente. Tuttavia, Rutherford fu il primo a ipotizzare l'esistenza di un nucleo atomico composto da protoni.
Chi ha scoperto i neutroni?
Successivamente alla deduzione di Rutherford, la comunità scientifica cominciò a misurare la massa delle particelle subatomiche.
I conti però non tornavano. La somma della massa dei protoni e degli elettroni era almeno la metà della massa dell'atomo.
Gli scienziati ipotizzarono l'esistenza di un'altra particella subatomica nel nucleo, con massa simile a quella dei protoni ma con carica elettrica neutra.
La particella neutra fu chiamata neutrone.
Anche in questo caso fu una deduzione corretta. Nel 1932 il fisico inglese James Chadwick osservò per la prima volta i neutroni nel nucleo di un atomo.
La vita media di un neutrone. Un neutrone libero nello spazio, quando è slegato dai protoni, ha una vita media di circa 904 secondi. Trascorso questo periodo il neutrone si trasforma in un protone e in un elettrone. Quando il neutrone è legato a uno o più protoni è, invece, stabile per un tempo indefinito.
Quanti sono i neutroni nel nucleo atomico?
Conoscendo il numero atomico ( Z ) e il numero di massa ( A ) si può ottenere per differenza il numero dei neutroni ( N ) presenti nel nucleo.
N = A - Z
Nota. Il numero atomico ( Z ) è il numero dei protoni nel nucleo atomico. Il numero di massa ( A ) è, invece, il numero dei nucleoni ( protoni + neutroni ) presenti nel nucleo dell'atomo.
Negli atomi con numero atomico fino a trenta ( Z < 30 ) il numero di neutroni è pari a quello dei protoni.
Possono comunque esistere degli atomi stabili con pari numero atomico ma diverso numero di massa. Questi casi sono detti isotopi.
Cos'è il nuclide?
Le varie combinazioni tra il numero atomico ( Z ), il numero di massa ( A ) e stato energetico esistenti in natura sono dette nuclidi.
Un nuclide è il nucleo considerato come un'entità a sé stante.
Nota. I nuclidi con lo stesso numero atomico hanno lo stesso numero di protoni e un numero differente di neutroni, sono detti isotopi.
La forza nucleare ( interazione nucleare forte )
I nucleoni sono legati tra loro nel nucleo atomico da una forza nucleare detta interazione nucleare forte.
Si tratta di una forza molto intensa che però agisce in un raggio di spazio molto limitato, circa 10-15 metri.
Nota. La forza nucleare è nettamente superiore alla forza di Coulomb che, invece, tende a far allontanare tra loro i nucleoni con la stessa carica elettrica ( protoni ).
L'energia che lega tra loro i nucleoni è detta energia di legame.
Il nucleo atomico
