Come calcolare il numero dei neutroni dell'atomo
Per calcolare il numero dei neutroni in un atomo esistono due metodi, uno per gli atomi regolari e un altro per gli atomi isotopi.
Il numero dei neutroni di un atomo regolare
Per calcolare la quantità dei neutroni in un atomo regolare è necessario disporre di due informazioni sull'elemento chimico, entrambe sono disponibili sulla tavola periodica degli elementi:
- Il numero atomico ( Z ). Il numero atomico ( numero dei protoni ) dell'atomo è generalmente situato sopra il simbolo dell'elemento chimico.
- Il numero di massa ( A ). Il numero di massa ( o peso atomico ) dell'elemento è indicato sotto il simbolo dell'elemento chimico.
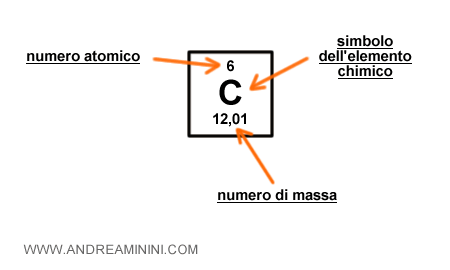
Nota. Se il peso atomico è un numero decimale, si approssima al numero intero. Ad esempio, il numero di massa del carbonio C è 12,01 e pertanto si approssima a 12.
Per ottenere il numero dei neutroni dell'atomo regolare è sufficiente sottrarre il numero atomico ( Z ) dal numero di massa ( A ) dell'elemento chimico.
N = M - Z
Esempio. Il carbonio ha un numero atomico pari a sei ( Z=6 ) e un numero di massa approssimato pari a dodici ( A=12 ). Pertanto, l'atomo regolare di carbonio ha sei neutroni.
N = A - Z = 12 - 6 = 6
Il numero dei neutroni in un atomo isotopo
Quando si tratta di un atomo isotopo il metodo di calcolo del numero dei neutroni è diverso.
Cos'è un isotopo?
E' un atomo con una quantità di neutroni differente rispetto a quella tipica dell'elemento chimico.
Anche in questo caso è necessario trovare nella tavola periodica il numero atomico dell'atomo regolare dell'elemento chimico, ossia la quantità di protoni nell'atomo nella sua forma non isotopica.
Nella tavola periodica il numero atomico è indicato sopra il simbolo dell'elemento chimico.
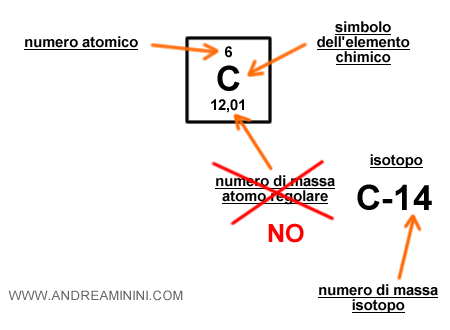
In questo caso, però, non va preso il numero di massa dell'atomo regolare ma quello dell'isotopo.
Dove si trova il numero di massa dell'isotopo?
Il numero di massa atomica dell'isotopo, invece, è indicato nel suo nome, è il numero dopo il trattino che segue il simbolo dell'elemento chimico.
Esempio. L'isotopo C-14 del carbonio ha un numero di massa pari a quattordici.
Una volta trovato il numero di massa atomica dell'isotopo è sufficiente calcolare la differenza tra il numero di massa e il numero atomico, come nel caso precedente.
N = M - Z
Esempio. L'isotopo C-14 ha un numero atomico pari a sei ( Z=6 ) e un numero di massa pari a quattordici ( A=14 ). Quindi, l'isotop ha otto neutroni
N = A - Z = 14 - 6 = 8
