La pressione osmotica
La pressione osmotica è l'aumento delle particelle di solvente in una soluzione che si verifica per osmosi quando tra una soluzione e un solvente puro interpongo una membrana semipermeabile.
L'osmosi è il passaggio spontaneo delle molecole del solvente puro alla soluzione tramite una membrana semipermeabile.
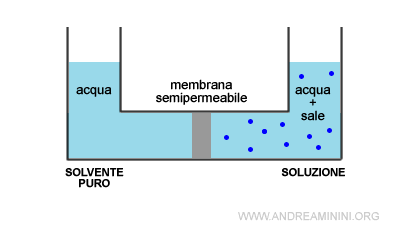
Nota. La membrana semipermeabile lascia passare le molecole del solvente (acqua) ma impedisce il passaggio delle molecole del soluto perché sono troppo grandi .
Durante l'osmosi aumenta progressivamente la quantità delle particelle di solvente nella soluzione.
Quindi, si riduce la concentrazione del soluto nella soluzione.
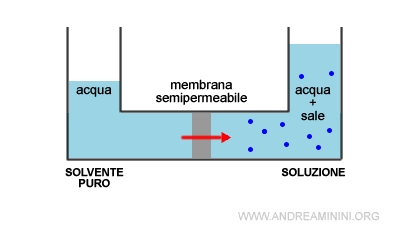
In questo modo la soluzione viene progressivamente diluita.
Nota. La membrana semipermeabile lascia passare le particelle del solvente ma non quelle del soluto.
L'arrivo delle particelle del solvente nella soluzione causa un aumento della pressione nella soluzione detta pressione osmotica.
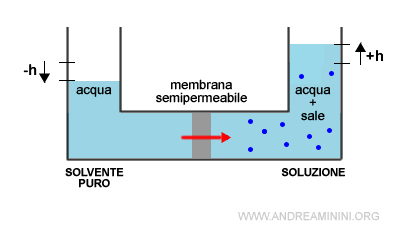
Il processo termina quando il sistema raggiunge una condizione di equilibrio dinamico in cui il numero delle molecole del solvente puro (acqua) che passano per la membrana semipermeabile è uguale in entrambi i versi.
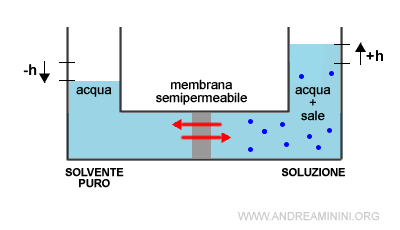
Anche in condizioni di equilibrio dinamico il livello del liquido della soluzione è più alto (+h) e quello del solvente puro è più basso (-h).
La pressione osmotica è la pressione necessaria (π) per impedire il flusso delle molecole per osmosi.
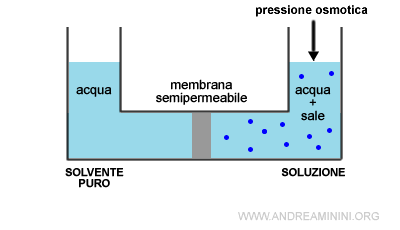
Quando la soluzione è molto diluita, in condizioni di equilibrio vale una relazione tra la concentrazione del soluto nella soluzione e la pressione osmotica.
$$ \pi V = n R T $$
Dove π è la pressione osmotica della soluzione, V è il volume della soluzione, n è il numero di moli del soluto, R è la costante universale dei gas e T è la temperatura assoluta.
Nota. La relazione precedente è molto simile all'equazione di stato dei gas.
Pertanto, per calcolare la pressione osmotica posso usare questa formula
$$ \pi = \frac{n R T}{V} $$
Sapendo che n/b è la molarità M posso anche scrivere
$$ \pi = M R T $$
Da questa formula si capisce che il fenomeno della pressione osmotica è proporzionale al numero delle moli (n) ossia delle particelle presenti nella soluzione.
Per questa ragione la pressione osmotica è una delle proprietà colligative delle soluzioni.
Nota. Il fenomeno dell'osmosi si presenta anche tra due soluzioni con diversa composizione. In questo caso il flusso delle particelle del solvente (es. acqua) si sposta dalla soluzione con minore concentrazione verso quella a maggiore concentrazione. Di conseguenza, la soluzione a maggiore concentrazione viene diluita dal solvente proveniente dalla soluzione a concentrazione minore. Si parla di diluizione per osmosi.
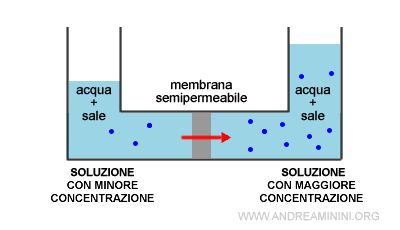
Le soluzioni che hanno la stessa pressione osmotica sono dette soluzioni isotoniche.
Le soluzioni con pressione osmotica più alta rispetto a un'altra soluzione sono dette soluzioni ipertoniche.
Quelle con pressione osmotica più bassa sono dette soluzioni ipotoniche.
L'osmosi inversa
Applicando una pressione superiore alla pressione osmotica il flusso si inverte, il flusso d'acqua si sposta dalla soluzione all'acqua pura.
Questo fenomeno è detto osmosi inversa.
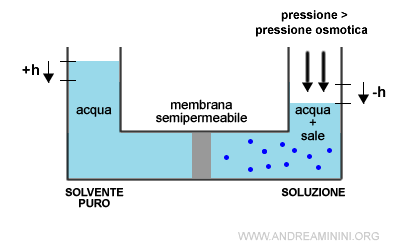
Ha diverse applicazioni pratiche. Può essere usato per ottenere una maggiore quantità del solvente puro.
Ad esempio può essere usato per la desalinizzazione dell'acqua.
E così via.
