La relazione tra solubilitÓ e temperatura
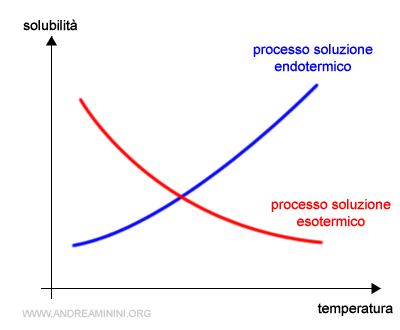
La solubilità aumenta con la temperatura se il processo di soluzione è endotermico (assorbe calore), si riduce se è esotermico (cede calore).
Il processo di soluzione posso semplificarlo in questo modo
$$ soluto + solvente \rightarrow soluzione \pm calore $$
Se il processo è esotermico il segno del calore è positivo (+) perché la soluzione cede calore all'esterno.
Viceversa, se il processo è endotermico il segno del calore è negativo (-) perché la soluzione assorbe calore dall'esterno.
I processi sono spiegabili tramite il principio di Le Chatelier.
Nota. Va comunque detto che questa regola non è generale. Ci sono diverse eccezioni perché alcune sostanze la violano. Pertanto, è sempre necessario fare riferimento ai dati raccolti in modo sperimentale. Ad esempio, in alcune sostanze il processo di soluzione è endotermico fino a una certa temperatura T, poi diventa esotermico.
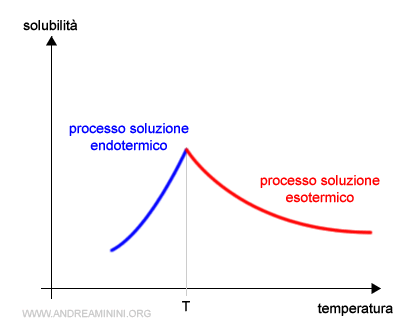
C'è però una regola generale molto importante che si verifica comunque in tutte le soluzioni regolari e non regolari: mantenendo la temperatura costante, la solubilità non cambia. Pertanto, anche se una sostanza presenta una curva irregolare, per fare in modo che il processo sia esotermico o endotermico basta modificare le condizioni ambientali alla temperatura opportuna.
Un esempio pratico
Esempio 1 (processo soluzione esotermico)
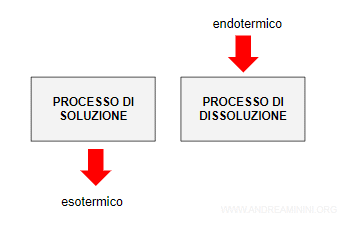
Prendo in considerazione un processo di soluzione esotermico che avviene con sviluppo di calore.
Di conseguenza il processo inverso di dissoluzione è un processo endotermico che assorbe calore.
Un aumento di temperatura aumenta il calore assorbito dal sistema.
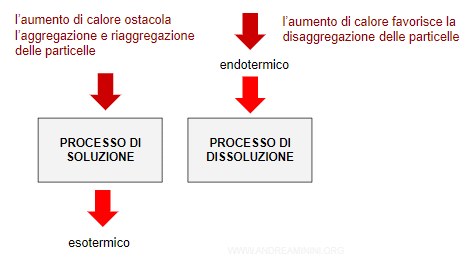
Il maggiore calore assorbito dal sistema ha due effetti
- favorisce la dissoluzione (disaggregazione delle particelle) perché il processo è endotermico
- ostacola la riaggregazione delle particelle perché il processo è esotermico.
Secondo il principio di Le Chatelier c'è quindi da aspettarsi che la solubilità del sistema aumenta con la temperatura.
Esempio 1 (processo soluzione endotermico)
Un processo di soluzione è endotermico, avviene con assorbimento di calore.
Pertanto, il processo contrario di dissoluzione è esotermico, si verifica con cessione di calore.
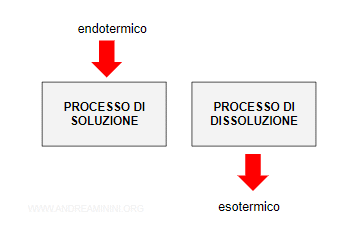
Un aumento di temperatura comporta l'assorbimento di calore dal sistema.
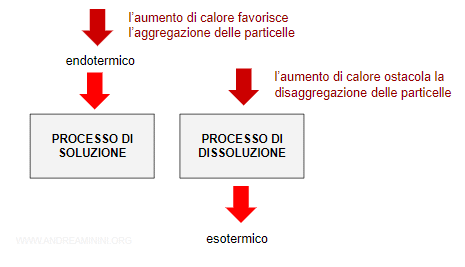
L'aumento del calore nel sistema causa due effetti
- ostacola il processo di dissoluzione (disaggregazione delle particelle) in quanto è esotermico
- favorisce il processo di aggregazione tra le particelle in quanto è endotermico
Essendo più difficile separare le particelle, in questo caso la solubilità si riduce con la temperatura.
E così via
