La soluzione liquida
Le soluzioni liquide sono soluzioni composte da un solvente allo stato liquido e uno o più soluti.
In una soluzione liquida i soluti allo stato solido o aeriforme si sciolgono passando alla fase liquida.
Le soluzioni liquide possono essere di tre tipi
- Soluzione gas-liquido
Il solvente è un liquido, il soluto è aeriforme (gas o vapore). Ad esempio, l'anidride carbonica (CO2) disciolta nell'acqua di una bevanda gassata. - Soluzione liquido-liquido
Sia il solvente che il soluto sono liquidi. Ad esempio, l'acetone disciolto nell'acqua. - Soluzione solido-liquido
Il solvente è un liquido, il soluto è un solido. Ad esempio, il sale o lo zucchero disciolti nell'acqua.
La solubilità di gran parte delle soluzioni liquide è limitata a una quantità massima del soluto, espressa in grammi, in un'unità di volume del solvente (es. 100 grammi).
Se il soluto è presente nella quantità massima, la soluzione è detta soluzione satura.
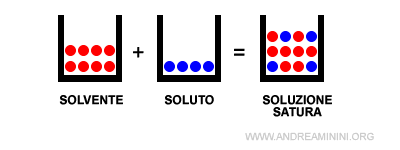
Se il soluto è presente in quantità superiori è detta soluzione sovrasatura.
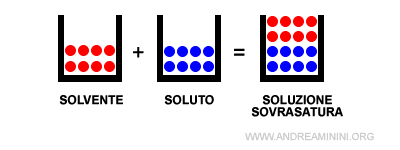
Nota. In una soluzione sovrasatura il soluto cessa di sciogliersi nel solvente e il sistema diventa eterogeneo. Ad esempio, una parte del soluto cristallizza depositandosi come corpo di fondo.
Se il soluto è presente in quantità inferiori è detta soluzione insatura.
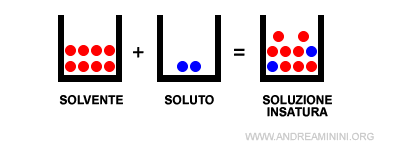
Nota. Una soluzione insatura di un soluto in un solvente è detta "diluita" se il soluto è molto inferiore rispetto alla quantità di saturazione. Se è poco inferiore, invece, è detta "concentrata"
In alcuni casi le soluzioni possono formarsi in tutte le proporzioni tra solvente e soluto.
Le sostanze sono dette miscibili.
Esempio. L'acqua e gli alcoli sono miscibili perché la soluzione si forma in qualsiasi proporzione tra solvente e soluto.
Come si forma una soluzione liquida
La formazione di una soluzione dipende dalla struttura chimica del solvente e del soluto, oltre che dalle condizioni ambientali (temperatura).
I solventi possono essere polari (es. acqua) o non polari (es. benzene).
I soluti possono essere polari (es. sali, zucchero) o non polari (es. olio).
Generalmente, le soluzioni liquide sono composte da sostanze con forze intermolecolari simili, dello stesso tipo e grandezza perché le forze attrattive agevolano la miscibilità tra solvente e soluti.
- I soluti polari tendono a sciogliersi nei solventi polari (es. acqua e sale), non sono invece solubili nei solventi non polari (es. acqua e benzene non formano una soluzione).
- I soluti non polari (o poco polari) tendono a sciogliersi nei solventi non polari.
La formazione di una soluzione a pressione costante è associata a una variazione di entalpia.
Il processo di formazione di una soluzione avviene in tre fasi:
- Le particelle del solvente si allontanano tra loro vincendo le interazioni solvente-solvente. Poiché devono superare le forze intermolecolari, questo processo richiede energia ed è endotermico (ΔH1>0).
- Le particelle del soluto si allontanano tra loro vincendo le interazioni soluto-soluto. Poiché devono superare le forze intermolecolari, questo processo richiede energia ed è endotermico. (ΔH2>0).
- Le particelle del solvente e del soluto si avvicinano tra loro tramite la forza attrattiva solevente-soluto. Questo processo implica un guadagno di energia del sistema ed è un processo esotermico (ΔH3<0).
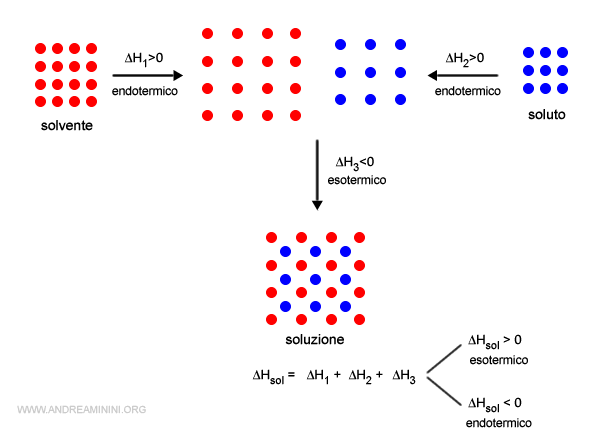
La somma delle variazioni di entalpia del processo è detta entalpia di soluzione .
Se la variazione di entalpia della soluzione è diversa da zero la soluzione è detta soluzione reale.
Il processo di formazione della soluzione reale può essere endotermico o esotermico
$$ \Delta H_{sol} = \Delta H_1 + \Delta H_2 + \Delta H_3 $$
- Esotermico
Se l'interazione solvente-soluto è più forte delle interazioni solvente-solvente e soluto-soluto, allora il processo è esotermico. La variazione di entalpia di soluzione è negativa (ΔHsol<0). - Endotermico
Se l'interazione solvente-soluto è più debole delle interazioni solvente-solvente e soluto-soluto, allora il processo è endotermico. La variazione di entalpia di soluzione è positiva (ΔHsol>0).
Se il fattore entalpico è molto alto ΔHsol>0 la formazione della soluzione potrebbe essere impedito dal punto di vista termodinamico.
Esempio. L'interazione tra acqua e benzene è bassa perché il benzene è apolare mentre l'acqua è polare. In questo caso i processi endotermici di separazione delle molecole di benzene e di acqua comporta una variazione positiva di entalpia (ΔH1+ΔH2) molto superiore alla riduzione di entalpia dovuta alla formazione della soluzione (ΔH3). L'energia liberata dalla soluzione è decisamente minore rispetto all'energia consumata dai processi endotermici di separazione delle molecole. Per questa ragione la soluzione acqua-benzene non si forma.
Se la variazione di entalpia della soluzione è pari a zero la soluzione è detta soluzione ideale.
$$ \Delta H_{sol} = 0 $$
Le interazioni soluto-solvente eguagliano le interazioni solvente-solvente e soluto-soluto.
In questo caso la formazione della soluzione dipende dal contributo entropico della soluzione (ΔSsol>0) e dalla riduzione dell'energia libera (ΔGsol<0) della soluzione.
Viceversa, si parla di soluzione reale se la variazione di entalpia della soluzione è entalpia positiva (ΔH>0) o negativa (ΔH<0).
Nota. Generalmente, se una soluzione gassosa è sempre una soluzione ideale.
La soluzione secondo la termodinamica
Nel processo di formazione di una soluzione la variazione di entalpia può essere positiva (esotermica) o negativa (endotermica) a seconda della somma algebrica di entalpia dei processi di separazione soluto-soluto e solvente-solvente e del processo di aggregazione solvente-soluto.
$$ \Delta H_{sol} = \Delta H_1 + \Delta H_2 + \Delta H_3 $$
La variazione di energia libera è, invece, sempre minore di zero.
$$ \Delta G_{sol} <0 $$
La variazione di entropia è solitamente positiva (ΔS>0) perché il grado di disordine aumenta in una soluzione.
$$ \Delta S_{sol} >0 $$
I componenti chimici sono inizialmente separati. E' quindi più facile trovarli (ordine).
Con la formazione della soluzione si disperdono (disordine). Pertanto, l'entropia aumenta.
Nota. In alcuni casi particolari l'entropia di una soluzione può essere negativa (ΔS<0) quando gli ioni determinano una forte orientazione delle molecole del solvente.
In una soluzione ideale la variazione di entropia è sempre positiva.
Essendo un processo spontaneo, la soluzione ideale è caratterizzata da un aumento di entropia (ΔS>0) e una riduzione di energia libera (ΔG<0).
La variazione di entalpia è ovviamente nulla (ΔH=0).
In una soluzione reale invece bisogna considerare la variazione di entalpia positiva (ΔH>0) o negativa (ΔH<0).
Se il fattore entalpico è molto alto (ΔH>0) la soluzione non si forma.
Un esempio pratico
La soluzione di acqua e benzene non si forma.
La separazione delle molecole di benzene e delle molecole d'acqua sono processi endotermici che richiedono energia per rompere i legami chimici.
$$ \Delta H_1>0 \\ \Delta 2_1>0 $$
Pertanto, l'entalpia del sistema aumenta di una quantità pari a ΔH1 + ΔH2
L'iterazione tra le molecole d'acqua e benzene è però scarsa, in quanto le molecole di benzene sono apolari mentre quelle di acqua sono molecole polari.
Nota. Una regola empirica delle soluzioni è che "il simile scioglie il simile". In questo caso le molecole di benzene e acqua non sono simili.
Pertanto, l'energia liberata dal processo di aggregazione è molto bassa e non compensa l'energia impiegata dai processi di formazione.
La variazione positiva di entalpia del processo di aggregazione ΔH3>0 non compensa la variazione negativa dei processi di separazione
$$ \Delta H_{sol} = \Delta H_1 + \Delta H_2 + \Delta H_3 < 0 $$
Per questa ragione la soluzione acqua-benzene non si forma.
La solvatazione
Nella solvatazione le molecole del soluto si circondano delle molecole del solvente, con le quali formano dei legami molto forti.
La solvatazione è detta idratazione se il solvente è l'acqua.
E così via.
