Innalzamento della temperatura di ebollizione
La temperatura di ebollizione di una soluzione tra il solvente A e il soluto non volatile B è superiore alla temperatura di ebollizione del solvente A puro. $$ \Delta T_{eb} = K_{eb} \cdot m $$ L'aumento è proporzionale alla molalità (m) del soluto B nella soluzione moltiplicato per la costante ebullioscopica Keb.
Considerando l'aumento del punto di ebollizione, la temperatura di ebollizione della soluzione è
$$ T_{eb} = T_{eb(solvente \: puro)}+ \Delta T_{eb} $$
La costante ebullioscopica Keb misura l'aumento della temperatura °C di 1 mole di soluto in una quantità di solvente puro.
Ogni solvente è caratterizzato da una propria costante ebullioscopica.
Esempio. La costante ebullioscopica dell'acqua è Keb=0.52°C kg/mol. Pertanto, una mole di soluto disciolta in 1000 grammi d'acqua aumenta la temperatura di ebollizione di 0.52°C della soluzione rispetto al solvente puro (acqua al 100%). Nel caso del benzene la costante ebullioscopica è Keb=2.53°C kg/mol.
L'aumento della temperatura di ebollizione è dovuto all'abbassamento della tensione vapore del solvente quando aumenta la frazione molare del soluto nella soluzione.
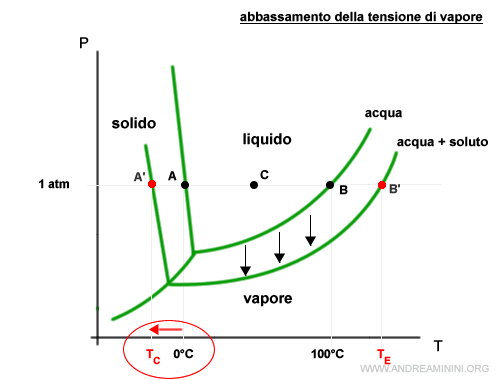
L'abbassamento della tensione vapore aumenta il punto di ebollizione della soluzione rispetto al solvente allo stato puro.
E' una delle proprietà colligative delle soluzioni.
Nota. Il soluto non volatile ha una tensione di vapore trascurabile. Pertanto, all'aumentare del soluto nella soluzione le particelle del solvente hanno minore probabilità di evaporare.
E così via.
